
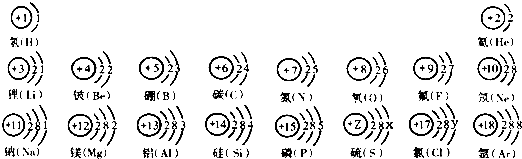
核电荷数为1~18的元素的原子结构示意图等信息如下,请回答下列问题:

(1)不同种元素最本质的区别是 (选填序号)。
| A.质子数不同 | B.最外层电子数不同 | C.中子数不同 | D.相对原子质量不同 |
(2)在第三周期中,各原子结构的共同之处是 ;该周期中,各原子核外电子排布的变化规律是 。
(3)在第三周期中,元素类型的变化情况是:从左到右由 元素过渡到 元素,并以稀有气体元素结尾。
(4)写出核外电子排布与氖原子相同的阳离子和阴离子符号各一个:阳离子 ,阴离子 。
试题分析:
(1)元素是具有相同核电荷数(质子数)的一类原子的总称。由定义知,只要核电荷数、质子数相同,这一类原子就属于同种元素。所以不难理解,元素与元素最本质的区别在于质子数不同。
(2)观察第三周期原子结构示意图,不难得出各原子结构的共同之处是各原子的电子层数相同,各原子核外电子排布的变化规律是最外层电子数依次递增。
(3)第三周期中,开头的一些元素为金属元素,如锂、铍等,非金属元素居中,如硼、碳等,最后为稀有气体元素结尾。
(4)氖原子的核外电子排面为第一层2个,第二层8个。阳离子是原子失去电子形成的,那该原子应该有3个电子层,且第3层上的电子数小于4,所以符合答案的有钠离子、镁离子、铝离子等。阴离子是原子得到电子形成的,那该原子应该有2个电子层,且最外层上的电子数大于4,满足要求的有氧离子、氟离子等。


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 ,则该离子带
,则该离子带查看答案和解析>>
科目:初中化学 来源: 题型:
| 最外层电子数 电子层数 |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 一 | H | He | ||||||
| 二 | Li | Be | B | C | N | O | F | Ne |
| 三 | Na | Mg | Al | Si | P | S | Cl | Ar |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (1)在第二周期中,各原子结构的共同之处是
(1)在第二周期中,各原子结构的共同之处是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com