
| 第1次 | 第2次 | 第3次 | |
| 稀盐酸 | 50g | 100g | 150g |
| 剩余固体 | 4g | 2g | 2g |
分析 由表格数据分析可知,第3次加入稀盐酸,剩余固体质量不再减小,说明剩余固体全部为杂质,样品中碳酸钙的质量为样品与杂质质量的差;进而可计算出该大理石样品中碳酸钙的质量分数;由样品中碳酸钙的质量,由反应的化学方程式列式计算出生成二氧化碳的质量即可.
解答 解:(1)由表格数据分析可知,第3次加入稀盐酸,剩余固体质量不再减小,说明剩余固体全部为杂质,即杂质的质量为2g,则大理石中碳酸钙的质量分数是$\frac{12g-2g}{12g}$×100%≈83.3%.
(2)12g大理石样品中碳酸钙的质量为12g-2g=10g;设生成二氧化碳的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
10g x
$\frac{100}{44}=\frac{10g}{x}$ x=4.4g
答:(1)该石灰石样品中碳酸钙的质量分数是62.5%;(2)生成的二氧化碳气体4.4g.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,细致地分析题意图表信息是正确解答本题的前提和关键.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
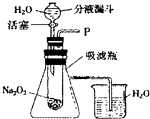 “在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来了.”
“在学校的元旦联欢会上,某同学表演了‘水能生火’的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来了.”查看答案和解析>>
科目:初中化学 来源: 题型:填空题
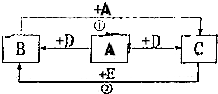 如图,A、B、C、D、E均是初中化学的常见物质,A、B、C均含有同一种元素.变化②的现象是颜色由红变黑,相应变化的生成物没有全部列出,各变化的条件也未标出.回答下列问题:
如图,A、B、C、D、E均是初中化学的常见物质,A、B、C均含有同一种元素.变化②的现象是颜色由红变黑,相应变化的生成物没有全部列出,各变化的条件也未标出.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
| 1、用托盘天平称量12.25g氯酸钾在试管中加热,把带火星的木条伸入试管. | 木条上的火星变亮. |
| 2、取与操作1相同质量的氯酸钾和2.5g二氧化锰,混合均匀后在试管中加热,把带火星的木条伸入试管. | 产生大量气体,木条复燃. |
| 3、待反应完全后,将试管中的剩余物加足量的水溶解,过滤,并将全部滤渣洗涤、干燥、用托盘天平称量. | 称量固体的质量是2.5g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 花香四溢--分子在不断运动 | B. | 酿制美酒--分子本身发生改变 | ||
| C. | 空气液化--分子间间隔改变 | D. | 汽油挥发--分子体积变大 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com