
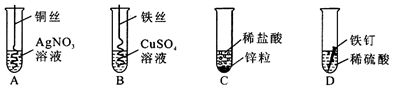
分析 根据在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强,据此进行分析判断.
在金属活动性顺序中,只有排在氢前的金属可以和稀酸溶液(除稀硝酸外)生成氢气,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,利用这一规律对问题进行判断分析即可.
解答 解:(1)将打磨的相同大小的铬片、铝片和铜片分别置于等质量分数的稀硫酸中,观察到铬片表面慢慢产生气泡,铝片表面迅速产生较多气泡,铜片表面无现象,说明三种金属中铝的活动性最强,铬其次,铜的活动性最弱.故铬、铝、铜金属活动性由强到弱的顺序是铝>铬>铜.
(2)由于在金属活动性顺序中铜>银,所以铜可以置换出银,并生成蓝色的硫酸铜溶液,所以其现象是铜丝表面附着一层银白色固体,溶液变为蓝色;
(3)C中是锌与稀盐酸的反应,锌的活动性在氢的前面,所以锌与稀盐酸可以反应生成氢气,其反应的方程式为:Zn+2HCl═ZnCl2+H2↑;
(4)用于证明铁、铜、银的金属活动性顺序实验是A、B,因为由A知铜能置换出硝酸银中的银,说明活动性铜>银,B中的铁能置换出硫酸铜中的铜,说明活动性铁>铜,所以可得活动性:铁>铜>银;
故答案为:(1)铝>铬>铜;
(2)铜丝表面附着一层银白色固体,溶液变为蓝色;Cu+2AgNO3=2Ag+Cu(NO3)2;
(3)Zn+2HCl═ZnCl2+H2↑;
(4)A、B.
点评 要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与酸反应,但氢后边的金属不会与酸反应,验证三种金属活动性顺序类问题时,一般采取“三取中”的方法进行设计实验,即选取活动性位于中间的那种金属的单质与另两种金属的盐溶液反应;或取中间金属的盐溶液与另两种金属的单质进行反应.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:初中化学 来源: 题型:选择题
| A. | 在氢氧化钠溶液中先加入一定量的稀硫酸,再逐滴加入硫酸铜溶液,无明显现象 | |
| B. | 在pH=12的氢氧化钠溶液中加入一定量的稀硫酸,用pH计测得溶液的pH值变为9 | |
| C. | 在氢氧化钠溶液中先滴加无色酚酞,再逐滴加入稀硫酸,看到酚酞红色逐渐变浅 | |
| D. | 在稀硫酸中加入一定量的氢氧化钠固体,用温度计测得溶液的温度显著升高 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 一定温度下将某硝酸钾溶液分成两等份,一份等温蒸发10克水,得到m克无水晶体;另一份等温蒸发12.5克水,得到3m克无水晶体,则该温度下硝酸钾的溶解度为( )
一定温度下将某硝酸钾溶液分成两等份,一份等温蒸发10克水,得到m克无水晶体;另一份等温蒸发12.5克水,得到3m克无水晶体,则该温度下硝酸钾的溶解度为( )| A. | 10m克 | B. | 24m克 | C. | 80m克 | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| ①用试管取少量小烧杯中反应后的溶液,滴加几滴酚酞试液(填酸碱指示剂) | 溶液变红色 | 该溶液显碱性 |
| ②将小烧杯中反应后剩下的溶液进行称量,然后滴加过量的BaCl2溶液 | 有 白色沉淀生成 | 猜想(4)不成立 |
| ③取步骤②中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(2)不成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 有一无色溶液X,分别加入氯化钡溶液、氢氧化钠溶液、氯化钠溶液,出现的现象如图所示,则溶液X是( )
有一无色溶液X,分别加入氯化钡溶液、氢氧化钠溶液、氯化钠溶液,出现的现象如图所示,则溶液X是( )| A. | H2SO4溶液 | B. | (NH4)2SO4溶液 | C. | NH4Cl溶液 | D. | Na2CO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com