
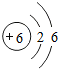
分析 (1)元素的化学性质决定于原子最外层电子数;
(2)根据提供的信息可以判断相关方面的问题;
(3)碳完全燃烧生成二氧化碳,不完全燃烧生成一氧化碳,碳和一氧化碳都可以用作燃料;
分子不同,性质则不同;
(4)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
实验室确定气体发生装置时应考虑的因素是反应物状态和反应条件;
(5)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据反应的化学方程式和提供的数据可以进行相关方面的计算.
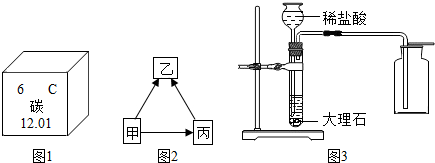
解答 解:(1)碳元素的化学性质与其原子的最外层电子数关系密切.
故填:最外层电子数.
(2)A.碳元素属于非金属元素,该选项说法正确;
B.碳原子核内质子数为6,该选项说法正确;
C.碳元素的原子结构示意图中,最外层电子数是4个,该选项不正确;
D.碳的相对原子质量为12.01,没有g,该选项说法不正确.
故填:AB.
(3)甲、乙、丙都是常见含有碳元素的物质,其中甲和丙都可以作燃料,乙和丙中所含的元素种类相同,乙能引起“温室效应”,则甲、乙和丙分别是碳、二氧化碳和一氧化碳,二氧化碳的化学式为CO2;
碳不完全燃烧生成一氧化碳,属于化合反应,反应的化学方程式为:2C+O2$\frac{\underline{\;不完全燃烧\;}}{\;}$2CO;
从微观的角度可知,二氧化碳和一氧化碳性质有差异的原因是二氧化碳和一氧化碳的分子不同.
故填:CO2;2C+O2$\frac{\underline{\;不完全燃烧\;}}{\;}$2CO;二氧化碳和一氧化碳的分子不同.
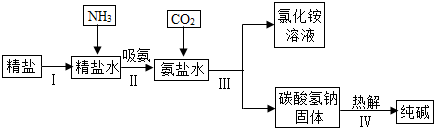
(4)将该装置中导气管中的橡胶管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到长颈漏斗和试管中出现液面差,即可证明装置不漏气;
实验室确定气体发生装置时应考虑的因素是反应物状态和反应条件.
故填:长颈漏斗和试管中出现液面差;反应物状态和反应条件.
(5)设碳酸钙质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4.4g
$\frac{100}{x}$=$\frac{44}{4.4g}$,
x=10g,
石灰石中杂质的质量分数为:$\frac{12.5g-10g}{12.5g}$×100%=20%,
答:石灰石中杂质的质量分数为20%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,同时考查了其它粉末的问题,计算时要注意规范性和准确性.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量(g) | 2.12 | 2.08 | 2.04 | 2.04 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是( )
如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是( )| A. | t2℃时,甲、乙两种物质的溶解度相等 | |
| B. | 除去甲中的少量乙可采取冷却热饱和溶液的方法 | |
| C. | 分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙 | |
| D. | t1℃时,将20g丙放入50g水中,充分溶解后得到丙溶液的质量为70g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A | B | C | D | |
| 区分的物质 | 面粉和小苏打 | 硝酸铵和尿素 | 一氧化碳和二氧化碳 | 稀盐酸和稀硫酸 |
| 第一方案 | 分别加水溶解 | 分别溶解于水, 观察现象 | 分别通入澄清的石灰水 | 分别滴加硝酸钡溶液 |
| 第二方案 | 分别加入食醋 | 分别加熟石灰研磨 | 观察颜色 | 分别取样加水测温度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金属矿石源于自然界,因此冶炼矿石是环保无污染的 | |
| B. | 赤铁矿和磁铁矿的主要成分是一样的,冶炼所得产物均为生铁 | |
| C. | 金在自然界中主要以单质形式存在,冶炼金的过程中发生了化学变化 | |
| D. | 明矾是一种含铝的矿石,可用于自来水的净化过程 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将圆形滤纸折叠两次,分为一侧一层、一侧三层放在漏斗中 | |
| B. | 滤纸边缘低于漏斗口,用水湿润滤纸,使它紧贴漏斗内壁 | |
| C. | 将玻璃棒放在一层的滤纸上面 | |
| D. | 让需要过滤的水沿着玻璃棒缓慢倒入漏斗中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com