
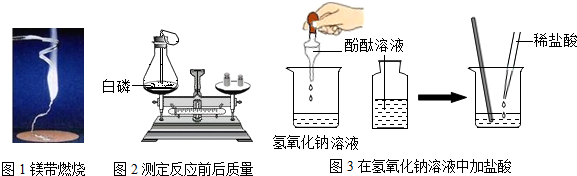
分析 (1)根据镁条燃烧的现象、质量守恒定律以及指示剂的变色情况来分析;
(2)根据反应的原理以及溶液颜色的变化来分析.
解答 解:(1)图1镁条在空气中燃烧发出耀眼的白光、放出热量、生成一种白色固体;参加反应的磷和氧气的质量之和与生成的五氧化二磷的质量相等,所以天平处于平衡状态;氢氧化钠显碱性,滴加无色酚酞试液后,溶液变红色,继续滴加稀盐酸,酸碱发生中和反应,当恰好完全中和时,溶液显中性,颜色由红色变成了无色;故填:发出耀眼的白光、放出热量、生成一种白色固体;参加反应的磷和氧气的质量之和与生成的五氧化二磷的质量相等;溶液由无色变成红色,又由红色变成无色;
(2)氢氧化钠与盐酸反应生成氯化钠和水,原溶液显碱性,能使无色的酚酞试液变红色,滴加稀盐酸后,溶液盐酸慢慢褪去,说明溶液的碱性消失,即盐酸与氢氧化钠发生了化学反应,中和反应的实质是氢离子和氢氧根离子结合成水.故填:NaOH+HCl=NaCl+H2O;酚酞在碱性溶液中显红色,在中性、酸性溶液中不变色;氢离子和氢氧根离子结合成水.
点评 本题主要考查了酸碱中和反应的验证,难度不大,注意在平时加强训练即可完成.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:初中化学 来源: 题型:选择题
 如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是( )
如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是( )| A. | t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c | |
| B. | t2℃时,将30g a物质放入50g水中充分溶解得到a的饱和溶液75 g(a物质不含结晶水) | |
| C. | 将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液溶质质量分数的关系是b>a=c | |
| D. | 将c的饱和溶液变为不饱和溶液,可采用降温的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 区分水和过氧化氢溶液,可以加入二氧化锰后看现象 | |
| B. | 区分硬水和软水:加肥皂水振荡看泡沫多少 | |
| C. | 区分氢氧化钠和硝酸铵:加水振荡看温度变化 | |
| D. | 区分氮气和二氧化碳:用燃着的木条看是否熄灭 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com