
| ��Ӧǰ���������� | ��Ӧ����������� |
| 13.5g | 8.7g |
���� ������ڶ������̵Ĵ������������Ȼ��غ����������������غ㶨�ɣ���Ӧǰ������������ļ��ٵ����������ɵ������������ݴ˸��ݷ�Ӧ�Ļ�ѧ����ʽ��ʽ������μӷ�Ӧ������ص�������������������������Ʒ�е�����������
��� �⣺��1���������غ㶨�ɣ���������������ΪΪ13.5g-8.7g=4.8g��
��2������Ʒ������ص�����Ϊx
2KClO3$\frac{\underline{MnO_2}}{��}$2KCl+3O2��
245 96
x 4.8g
$\frac{245}{96}=\frac{x}{4.8g}$ x=12.25g
��Ʒ������ص���������Ϊ��$\frac{12.25g}{12.5g}$��100%=98%��
�����������Ʒ�е�����������98%��
���� �����ѶȲ������ո��ݻ�ѧ����ʽ�ļ��㼴����ȷ����⣬���������غ㶨�ɼ������������������ȷ������ǰ��ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ڢ� | C�� | �ڢۢ� | D�� | �٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
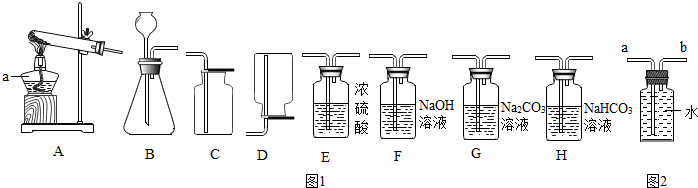
| ʵ�鲽�� | ʵ������ | ʵ����� |
| ��������HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
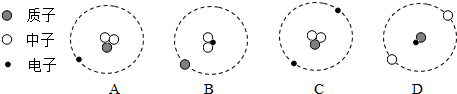
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
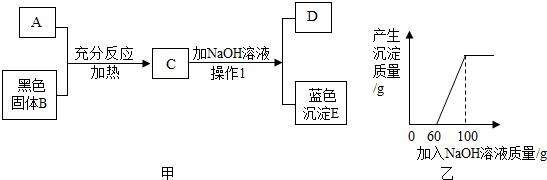
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ���ʳ����Ҫ�ɷ� | |
| B�� | C2H5OH��C��H��OԪ�ص���������2��6��1 | |
| C�� | �Ҵ���������ˮ | |
| D�� | C2H5OH��CԪ�ص�����������$\frac{12��2}{12��2+1��6+16��1}$��100% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
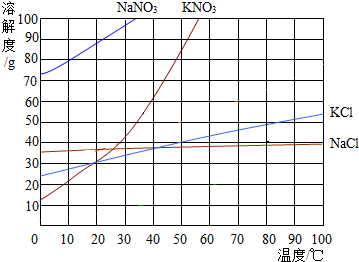 ��ͼΪ���ֹ�����ܽ�����ߣ��ش��������⣺
��ͼΪ���ֹ�����ܽ�����ߣ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NO2��Fe2O3���������� | |
| B�� | �����ֶ������Ͻ� | |
| C�� | ������Һ�����ǻ���� | |
| D�� | ���ʯ��ʯī������̼Ԫ����ɵĵ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com