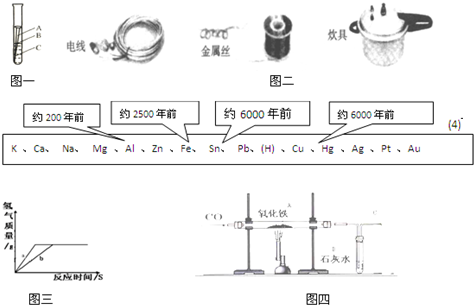
金属是一种重要的材料,人类的生活和生产都离不开金属,全世界每年因生锈损失的钢铁,约占世界年产量的十分之一.
(1)兴趣小组的同学想探究钢铁锈蚀的条件,他将一个干净的铁钉放入试管中(如图一),定期观察并记录现象.图一中最先锈蚀的部位______(填写A、B或C);举出一种防止钢铁锈蚀的具体方法______;
(2)根据图二的应用实例,试说出金属具有的一点物理性质______;
(3)铝的活动性比铁强,但铝在空气中却表现出良好的抗腐蚀性,原因是______;
(4)下表中不同的金属被开发、利用的年代不同,决定这一先后顺序的关键因素是______;
A.金属的活动性 B.金属的导电性
C.金属的延展性 D.地壳中金属元素的含量
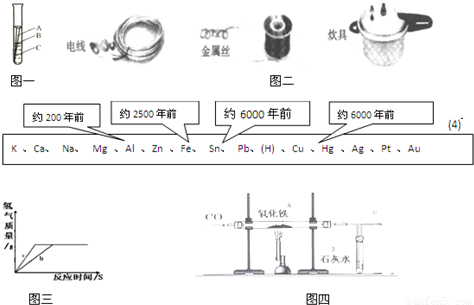
(5)用质量相等的镁粉和铝粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应,产生氢气的质量和反应所用时间的关系如图三所示.则下列说法中正确的是______;
A.曲线a、b分别表示镁、铝的反应情况 B.盐酸均反应完,镁恰好完全反应,铝剩余
C.盐酸均反应完,镁、铝也恰好完全反应 D.镁、铝都反应完,盐酸有剩余
(6)联想到工业上用铁矿石冶炼铁,他们在实验室用CO还原氧化铁,实验如图四所示
①A、B处发生的现象分别是A______、B______;
②为了防止溶液倒吸,本实验停止加热前是否要先断开A和B的连接处?______(填“需要”或“不需要”),理由是______.
| 反应时间 | t | t1 | t2 | t3 |
| 烧杯和药品的质量/g | 166.5 | 166.3 | 166.1 | 166.1 |
(7)兴趣小组的同学又准确称取了11.5克生铁样品,放入装有100.0g稀硫酸(足量)的烧杯中(烧杯质量为55.0g).在化学反应过程中对烧杯(包括溶液和残余固体)进行了四次称量,
记录如表.求:①反应中产生氢气______克;②反应后所得溶液中溶质质量分数.(结果精确到0.1%)

 工业上用铁矿石冶炼铁,他们在实验室用CO还原氧化铁,实验如图所示
工业上用铁矿石冶炼铁,他们在实验室用CO还原氧化铁,实验如图所示

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案