
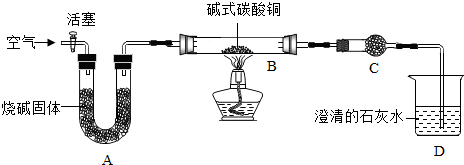
| 加热时间(min) | 0 | t1 | t2 | t3 |
| B中固体质量(g) | 6.66 | 5.20 | 4.80 | 4.80 |


科目:初中化学 来源: 题型:
| A、用活性炭除去冰箱中的异味 |
| B、用食醋除去热水瓶胆的水垢 |
| C、工业上从空气中分离出氧气 |
| D、用汽油清洗掉衣服上的油污 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为 Na2O |
| 方案2 | ①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | 白色物质为 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分(注:葡萄糖酸锌相对分子质量455;1g=1000mg),请回答:
儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分(注:葡萄糖酸锌相对分子质量455;1g=1000mg),请回答:查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
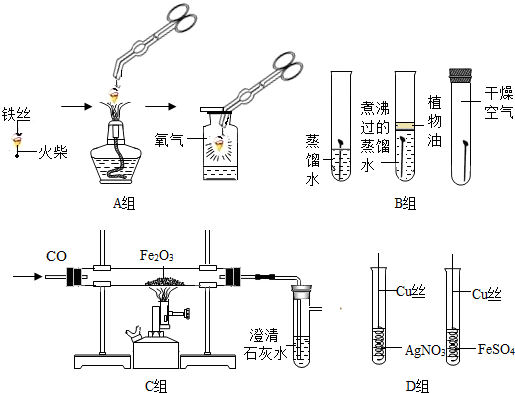
查看答案和解析>>
科目:初中化学 来源: 题型:
| 完 |
| ? |
| 全 |
| ? |

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com