(2013?长宁区二模)为探究“酸碱中和反应”,进行了如下研究.
【实验原理】将稀HCl滴入盛有NaOH溶液的烧杯中,反应的化学方程式为
HCl+NaOH=NaCl+H2O
HCl+NaOH=NaCl+H2O
;
【提出问题】实验中未观察到明显现象,同学们对该反应是否发生提出了疑问:反应后溶液中溶质是什么?
【假设猜想】溶液中的溶质有氯化钠,还可能有:
猜想1:HCl
猜想2:NaOH
猜想3:HCl和NaOH
你认为上述猜想不合理的是
3
3
.
【实验方案】(1)某同学用一支洁净试管取少量烧杯中的溶液,滴加FeCl
3溶液,无明显现象,说明烧杯中溶液里一定不含
NaOH
NaOH
;
(2)为了验证其余猜想,各小组进行如下三个方案的探究.
| 实验方案 |
甲 |
乙 |
丙 |
实验操作 |
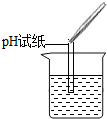 |
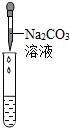 |
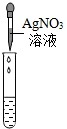 |
| 实验现象 |
试纸变色,对比比色卡,pH<7 |
有气泡产生 有气泡产生 |
产生白色沉淀 |
| 实验结论 |
溶液中有HCl |
溶液中有HCl |
溶液中有HCl |
【推论与分析】上述实验方案中有两处明显错误:
①实验操作中的错误是
将pH试纸直接伸到待测溶液中,会污染试剂
将pH试纸直接伸到待测溶液中,会污染试剂
;
②实验结论中也有一个是错误的,错误的原因是
NaCl与AgNO3反应也会生成白色沉淀,不能说明一定有HCl存在
NaCl与AgNO3反应也会生成白色沉淀,不能说明一定有HCl存在
;
通过对上述实验的正确操作,同学们得出了正确的结论.
你认为【假设猜想】中
猜想1或1
猜想1或1
是正确的.
(3)在20g10%的氢氧化钠溶液中加入25g稀盐酸恰好完全反应.
①计算氢氧化钠的物质的量为
0.05mol
0.05mol
;
②计算25g稀盐酸中溶质的质量分数
7.3%
7.3%
(计算结果精确到0.1%).(根据化学方程式列式计算)






 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案