目前全世界每天生产的石油约70%可以炼制成燃油,这些燃油完全燃烧后将可能产生 2.2×107吨的二氧化碳.利用二氧化碳合成尿素来减少温室气体的排放,其反应的化学方程式为:CO2+2NH3═CO(NH2)2+H2O.
(1)尿素[CO(NH2)2]的相对分子质量是______.
(2)若将每天燃油产生的二氧化碳全部转化为尿素,能合成多少吨尿素?
(3)若每生产1吨粮食需提供0.1吨氮元素,则每天合成的尿素可生产多少吨粮食?
【答案】
分析:(1)根据相对分子质量计算方法计算
(2)根据二氧化碳的质量求出尿素的质量
(3)根据尿素的质量求出氮元素质量,根据粮食与氮元素的质量关系求出粮食的质量.
解答:解:(1)尿素[CO(NH
2)
2]的相对分子质量=12+16+(14+1×2)×2=60
(2)设合成尿素的质量为x
CO
2+2NH
3═CO(NH
2)
2+H
2O.
44 60
2.2×10
7t x
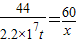
x=3×10
7t
(3)3×10
7t尿素中含氮元素的质量为3×10
7t×
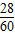
=1.4×10
7t
因每生产1吨粮食需提供0.1吨氮元素,故这些氮元素能生产粮食为1.4×10
7t×10=1.4×10
8t
答:(2)能合成多少吨尿素3×10
7t
(3)每天合成的尿素可生产1.4×10
8t粮食
故答案为:(1)60 (2)3×10
7t(3)1.4×10
8t
点评:本题考查相对分子质量以及根据化学方程式的简单计算,注意单位统一

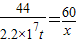
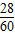 =1.4×107t
=1.4×107t

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案