
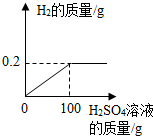
 取Cu-Zn合金10g,将该合金放入烧杯中,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与产生气体的质量关系如图所示.请计算:
取Cu-Zn合金10g,将该合金放入烧杯中,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与产生气体的质量关系如图所示.请计算:分析 根据生成的氢气的质量和对应的化学方程式求算反应的锌的质量和硫酸的质量,进而求算稀硫酸的溶质的质量分数.
解答 解:根据图可以看出生成的氢气的质量为0.2g
设参加反应的锌的质量为x,所消耗的硫酸中的溶质的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.2g
$\frac{65}{x}$=$\frac{98}{y}$=$\frac{2}{0.2g}$
x=6.5g
y=9.8g
则合金中铜的质量为10g-6.5g=3.5g
稀硫酸的溶质质量分数为$\frac{9.8g}{100g}$×100%=9.8%
答:(1)反应产生氢气的总质量为 0.2g.
(2)合金中铜的质量为3.5g.
(3)稀硫酸的溶质质量分数为9.8%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


科目:初中化学 来源: 题型:选择题
| A. | 镁+氧气$\stackrel{点燃}{→}$氧化镁 | B. | 红磷+氧气$\stackrel{点燃}{→}$五氧化二磷 | ||
| C. | 二氧化碳+水→碳酸 | D. | 蜡烛+氧气$\stackrel{点燃}{→}$二氧化碳+水 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 甲烷、空气、天然气 | B. | 澄清的石灰水、水银、精盐 | ||
| C. | 硫酸铜、胆矾、铜 | D. | 氯化钙、液态氧、纯盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com