
【题目】硫酸亚铁铵((NH4)2SO4·FeSO4·6H2O)俗称摩尔盐,可用于净水和治疗缺铁性贫血。工业上常利用机械加工行业产生的废铁屑(含有少量杂质 Fe2O3)为原料制备(如图)。
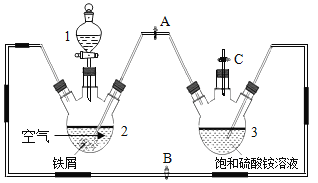
某化学兴趣小组拟用下列方案制备硫酸亚铁铵并进行相关探究。 查阅资料:
(1)FeSO4易被氧气氧化为Fe2(SO4)3,影响硫酸亚铁铵的等级。
(2)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体,该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(3)在0~60℃时,硫酸亚铁铵的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。
(探究一)用如上图所示装置制备硫酸亚铁铵。实验步骤如下:
①制备 FeSO4溶液:先关闭止水夹 A,再打开止水夹 B和 C,从分液漏斗滴加稀硫酸至三颈烧瓶2中,此装置中发生的化学反应主要有(用化学方程式表示)______、_______和![]() 。该过程中氢气的作用是______。
。该过程中氢气的作用是______。
②待装置中的铁屑快反应完时,关闭止水夹_______,打开止水夹_______,观察到的现象是_______。实验时为防止三颈烧瓶2中剩余铁屑通过导管进入三颈烧瓶3中,可采取的措施 是_______。
③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵晶体,从中获得硫酸亚铁铵晶体的主要实验操作为过滤、洗涤、干燥。为洗涤(NH4)2SO4·FeSO4·6H2O 粗产品,下列方法中最合适的是______。
A 用冷水洗 B 先用冷水洗,后用无水乙醇洗
C 用 30%的乙醇溶液洗 D 用 90%的乙醇溶液洗
(探究二)探究硫酸亚铁铵样品的纯度取5g硫酸亚铁铵晶体溶于50mL水配成溶液,等分成两份,分别进行实验。
方案一:![]()
(1)实验中加入过量BaCl2溶液的目的______。
(2)利用方案一测得的数据,计算该硫酸亚铁铵样品的纯度(列出具体计算步骤)。((NH4)2SO4·FeSO4·6H2O的相对分子质量:392)__________
方案二:如图所示,向另一份中加入过量的NaOH溶液,充分反应后得到NH3
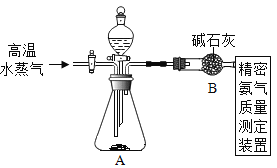
(3)(NH4)2SO4与NaOH反应的化学方程式为_______。
(4)实验中需不断通入高温水蒸气,其作用是_______。
(5)在实际测量中,利用方案二测得的样品纯度总是低于方案一测得的数值,可能的原因是______。
(探究三)对硫酸亚铁铵((NH4)2SO4·FeSO4·6H2O)晶体进行热重分析,温度与TG%的关系如下图所示
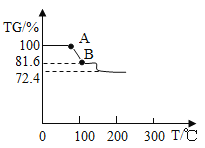
已知:温度低于 200℃,只有结晶水失去。
已知:TG% =![]()
TG%从 100%降低为 72.4%时,发生反应的化学方程式是_______ 。试计算AB段物质的化学式______________ 。
【答案】Fe+H2SO4=FeSO4+H2↑ Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 防止硫酸亚铁被氧化成硫酸铁 B、C A 2中的液体进入3中 放一块磁铁吸引铁粉 B 将硫酸根离子全部沉淀 78.4% (NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O 将装置内的氨气排出 水中会溶解一定量的氨气 FeSO4(NH4)2SO46H2O![]() FeSO4(NH4)2SO4+6H2O FeSO4(NH4)2SO42H2O
FeSO4(NH4)2SO4+6H2O FeSO4(NH4)2SO42H2O
【解析】
[探究一]①铁和硫酸反应生成硫酸亚铁和氢气,氧化铁和硫酸反应生成硫酸铁和水,化学方程式为:Fe+H2SO4=FeSO4+H2↑,Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;该过程中氢气的作用是防止硫酸亚铁被氧化成硫酸铁;
②待装置中的铁屑快反应完时,利用装置内的压强差,将2中的硫酸亚铁压入3中,所以待装置中的铁屑快反应完时,关闭止水夹B、C,打开止水夹A,观察到的现象是2中的液体进入3中,实验时为防止三颈烧瓶2中剩余铁屑通过导管进入三颈烧瓶3中,可采取的措施是:放一块磁铁吸引铁粉;
③硫酸亚铁铵晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇,所以为洗涤(NH4)2SO4FeSO46H2O 粗产品,最合适的是:先用冷水洗,后用无水乙醇洗,故选:B;
[探究二](1)氯化钡和硫酸根离子反应生成硫酸钡沉淀,所以实验中加入过量BaCl2溶液的目的:将硫酸根离子全部沉淀;
(2)设参加反应的硫酸亚铁铵的质量为x
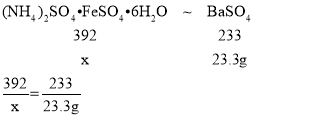
x=3.92g
所以该硫酸亚铁铵样品的纯度为:![]() ×100%=78.4%;
×100%=78.4%;
(3)硫酸铵和氢氧化钠反应生成硫酸钠、水和氨气,化学方程式为:(NH4)2SO4+2NaOH=Na2SO4+2NH3↑+2H2O;防止硫酸亚铁被氧化成硫酸铁;
(4)实验中需不断通入高温水蒸气,其作用是将装置内的氨气排出;
(5)氨气溶于水,所以在实际测量中,利用方案二测得的样品纯度总是低于方案一测得的数值,可能的原因是:水中会溶解一定量的氨气;
[探究三]通过分析可知,对硫酸亚铁铵[FeSO4(NH4)2SO46H2O]样品进行加热到100℃时,首先是固体表面的分子水蒸发得到硫酸亚铁铵[FeSO4(NH4)2SO46H2O],这一步是物理变化,继续加热到100-200℃时,已知200℃以前只有结晶水失去,因此硫酸亚铁铵[FeSO4(NH4)2SO46H2O]中的结晶水开始脱去,这一步是化学变化。
所以TG%从100%降低为72.4%时,发生反应的化学方程式是:FeSO4(NH4)2SO46H2O![]() FeSO4(NH4)2SO4+6H2O;
FeSO4(NH4)2SO4+6H2O;
假设硫酸亚铁铵晶体质量是392克,加热到200℃时,失去结晶水,剩下的硫酸亚铁铵质量为:392g×![]() =284g,固体质量分数减少为:
=284g,固体质量分数减少为:![]() ×100%≈72.4%,所以AB段物质的化学式为:FeSO4(NH4)2SO42H2O。
×100%≈72.4%,所以AB段物质的化学式为:FeSO4(NH4)2SO42H2O。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过下图所示操作流程:
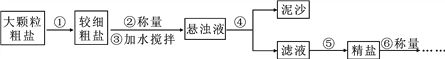
(1)操作①中必须用到的一种仪器是__________(填序号);
A.研钵 B.量筒 C.烧杯 D.试管
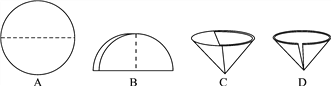
(2)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是_______(填序号);
(3)实验结束后称量获得的精盐,并计算精盐的产率,发现产率较低,其可能原因是___(填序号)。
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.器皿上沾有的精盐没全部转移到称量纸上
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。

(提出问题)久置固体的成分是什么?
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
(实验探究1)
甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 | 固体中一定含有______ |
(2)另取少量固体放于试管中,滴加足量的稀盐酸。 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有_______, 一定不含Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清的石灰水中 | 石灰水变浑浊 | 固体中一定含有______ |
(实验质疑)
乙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_______。
(实验探究2)
乙同学设计如下实验方案继续验证:
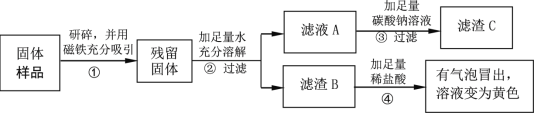
(1)③中反应的化学方程式是______。
(2)乙同学实验中又能得出固体样品中一定还含有______。
(3)乙同学又经过实验测得上述残留固体中含钙物质的总质量为1.6 g,滤渣B中CaCO3的质量为1.0 g,滤渣C的质量为1.0 g。
(实验结论)综合上述实验及所给数据,久置固体的成分是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校实验室有一包固体粉末可能由NH4Cl、Na2CO3、Ba(OH)2、BaCl2、Na2SO4中的一种或几种组成。为了确定其组成,某化学兴趣小组做了以下实验:
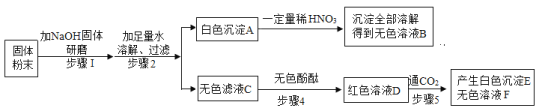
已知,步骤1中无明显现象;
请回答下列问题:
(1)这包固体中一定不存在的物质是_____;
(2)写出步骤2中产生白色沉淀A一定发生反应的化学方程式_____。
(3)步骤4所得红色溶液D中一定含有的溶质是_____。
(4)该实验小组实验结束后处理废液时,将无色溶液B、无色溶液F和沉淀E倒在了同一个废液缸里,发现沉淀消失并产生气泡,则废液缸中最终得到的废液中一定含有的溶质是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取 8g氢氧化钠固体,在空气中露置一段时间后,加入足量稀盐酸。充分反应后,下列说法正确的是()
A.氢氧化钠固体在空气中放置时间越久,反应中消耗的 HCl的质量越少
B.反应生成氯化钠的质量一定等于11.7g
C.氢氧化钠固体在空气中放置时间越久,固体中氧元素的质量分数越小
D.加入稀盐酸后,一定立即产生气泡
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列各实验,回答下列问题:
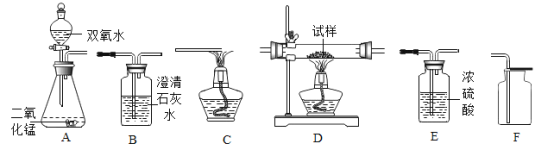
(1)该组欲在实验室中制备并收集干燥的氧气。
①所选仪器的连接顺序为____________(填写仪器序号字母)。
②制取氧气所发生反应的化学方程式为____________________________________。
③氧气在空气中有相对稳定的含量是由于在自然界中存在氧的循环,请写出自然界中消耗氧气的一条途径______________________。
(2)用干燥纯净的氧气对纤维素的组成进行分析探究实验(资料显示纤维素只含C、H、O三种元素)。所选装置按“氧气→D→E→B→碱石灰干燥管”的顺序连接(实验前检查装置的气密性,假设所发生的化学反应都完全充分进行)。装置B中出现的现象为___________,装置D的玻璃管中放入纤维素试样的质量为1.62g,充分反应后,测得装置E的质量增加0.9g,装置B的质量增加2.64g,通过计算可得出纤维素中C、H、O三种元素的质量比为___:___:_____(计算结果用最简整数比表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)如图是某同学査阅的氯化氢气体溶于水的示意图。从微观角度分析氯化氢气体不显酸性的原因是_____________。
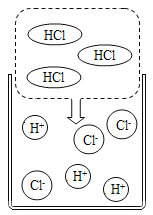
(2)用硫酸铜配制农药波尔多液,溶解硫酸铜时不宜用铁制容器。用化学方程式表示其原因:___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】牛奶中蛋白质含量的测定是通过测定“氮”的含量实现的。三聚氰胺是一种低毒性化工产品,婴幼儿大量摄入会引起泌尿系统疾病,严重危害人体健康。不法奶商在牛奶中添加化工原料三聚氰胺(分子结构如图所示),以提升食品检测中的蛋白质含量指标,因此三聚氰胺也被人称为“蛋白精”。
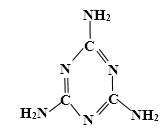
(1)下列对三聚氰胺描述中,属于的化学性质的是_____。
A 快速加热升华,升华温度300 ℃
B 三聚氰胺为纯白色单斜棱晶体,无味
C 溶于热水,微溶于冷水,极微溶于热酒精
D 在一般情况下较稳定,但在高温下可能会分解放出氰化物
(2)下列关于三聚氰胺的说法中,正确的是_____。
A 添三聚氰胺能提高牛奶中的含氮量,但危害人体健康
B 三聚氰胺属于有机化合物
C “蛋白精”不是蛋白质,添加三聚氰胺不能提高食物中蛋白质含量
(3)请根据三聚氰胺的分子结构式写出化学式_____,其化学式的含义为_____(只写一条含义)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了验证盐酸和氢氧化钠溶液可以发生反应,李华同学进行了相关实验,并用pH试纸测定溶液的pH。pH的变化曲线如图所示:
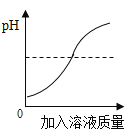
(1)要得到此变化曲线,所进行的操作是______(填序号)。
①将稀盐酸滴加到氢氧化钠溶液中 ②将氢氧化钠溶液滴加到稀盐酸中
(2)李华发现该反应过程中无明显的实验现象,为使实验现象明显,李华用了指示剂——______,改变实验步骤,往氢氧化钠溶液中加入该指示剂,溶液变______色,再往溶液中慢慢滴加盐酸,可以观察到______;用手触摸烧杯外壁,感觉到发热,说明该反应是______热量(填“放出”或“吸收”)。写出该反应的化学方程式______。此反应类型为______反应。
(3)此反应类型在生产生活中的应用相当广泛。如工厂排放出酸性废水,则常用______(写名称)来处理。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com