
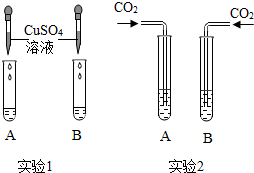
 氢氧化钠和氢氧化钙是两种常见的碱.甲同学将两种碱的溶液分别装入试管A、B,并进行了如图所示的二组实验.
氢氧化钠和氢氧化钙是两种常见的碱.甲同学将两种碱的溶液分别装入试管A、B,并进行了如图所示的二组实验.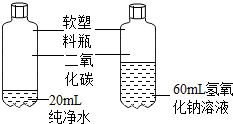 | 乙同学认为该实验设计不符合对比实验的基本 原则,理由是变量不唯一. |
| 实 验 操 作 | 实验现象 | 结 论 |
| I.取B中少量溶液于试管中,加入足量澄清石灰水. II.静置后,取上层清液,向其中加几滴酚酞试液. | 产生白色沉淀、溶液呈红色 | 猜想3成立 |
分析 ①根据氢氧化钠和硫酸铜的反应及反应物的量分析反应后溶液中的溶质,写出化学式;
②根据二氧化碳与氢氧化钙的反应写出反应的化学方程式;
③根据固定变量法探究物质性质的方法分析回答;
④碳酸钠溶液显碱性,能与氢氧化钙溶液反应生成碳酸钙沉淀,在判断溶液中同时含有碳酸钠和氢氧化钠时应先加入过量的氯化钡溶液(氯化钙、硝酸钙、硝酸钡)再加入酚酞试液来判断.
解答 解:①实验1中,若B中是NaOH溶液,氢氧化钠能与硫酸铜反应生成了蓝色氢氧化铜沉淀和硫酸钠,则清液中溶质的成分是Na2SO4,当氢氧化钠过量时还含有NaOH.
②实验2中,甲同学向两支试管中分别通入适量的二氧化碳,A(氢氧化钙溶液)中有白色沉淀生成,发生反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
③由实验的过程可知,该实验探究二氧化碳是否与氢氧化钠反应,实验设计不符合对比实验的基本原则,理由是变量不唯一;
④【实验探究】由于氢氧化钠与二氧化碳反应生成了碳酸钠和水,加入足量澄清石灰水时,碳酸钠与氢氧化钙反应生成了碳酸钙沉淀和氢氧化钠,再加入酚酞试液变成红色;所以实验的现象是:产生白色沉淀、溶液呈红色;
【反思与评价】
老师评价丙同学得出的结论不正确,原因是:操作Ⅰ中碳酸钠与氢氧化钙反应生成了NaOH,会对判断该溶质中是否含有NaOH造成干扰;
为了使“猜想3成立”,丙同学对上述“实验探究”进行了改动,他的做法是将操作1中的澄清石灰水改为氯化钡(或氯化钙、硝酸钙、硝酸钡)溶液,将碳酸钠全部反应掉,再加入酚酞试液来测定是否显碱性来判断氢氧化钠的存在.
故答为:①一定有Na2SO4、可能有NaOH;②Ca(OH)2+CO2=CaCO3↓+H2O;③变量不唯一,④【实验探究】产生白色沉淀、溶液呈红色;【反思与评价】操作Ⅰ中碳酸钠与氢氧化钙反应生成了NaOH,会对判断该溶质中是否含有NaOH造成干扰;将操作1中的澄清石灰水改为氯化钡(或氯化钙、硝酸钙、硝酸钡)溶液.
点评 本题主要考查了常见的两种碱氢氧化钠、氢氧化钙的性质,以实验探究的形式考查了学生依据所学知识分析和解答问题的能力,以及设计实验、据实验现象推导结论的能力,能较好考查生对碱的知识的掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
 甲物质的溶液可用作电镀液等.甲的溶解度曲线如图所示,下列说法正确的是( )
甲物质的溶液可用作电镀液等.甲的溶解度曲线如图所示,下列说法正确的是( )| A. | 甲的溶解度是102.5g | |
| B. | 甲的溶解度随温度的升高而增大 | |
| C. | 20℃时,100g甲的饱和溶液中溶质质量为28.6g | |
| D. | 将70℃甲的饱和溶液升温或降温,都有晶体析出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 造成空气污染的气体有一氧化碳、二氧化碳、二氧化硫等 | |
| B. | 采用加热煮沸的方法可降低水的硬度 | |
| C. | 氢氧化钠显碱性可以中和酸性土壤 | |
| D. | 汽油和洗涤剂除去油污都是乳化过程 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 水是我们身边的化学物质,请回答下列问题:
水是我们身边的化学物质,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:推断题
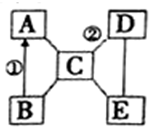 A、B、C、D、E是初中化学常见的五种不同类别的物质,其中B为红色固体,C是胃液的主要成分,E俗称苏打.图中“-”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去.
A、B、C、D、E是初中化学常见的五种不同类别的物质,其中B为红色固体,C是胃液的主要成分,E俗称苏打.图中“-”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 预期现象及实验结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com