
分析 (1)氧气浓度越大燃烧越剧烈;
(2)着火点越低越易点燃;
(3)与氧气接触面积越大,燃烧就越容易发生;
(4)可燃物越干燥越容易燃烧.
解答 解:(1)氧气浓度越大燃烧越剧烈,如硫在空气中燃烧发出微弱的淡蓝色火焰,而在氧气中燃烧得更旺,发出蓝紫色火焰;故填:氧气浓度越大燃烧越剧烈,如硫在空气中燃烧发出微弱的淡蓝色火焰,而在氧气中燃烧得更旺,发出蓝紫色火焰;
(2)着火点越低越易点燃,如白磷着火点低,相同条件下自磷比红磷易被点燃;故填:可燃物的着火点越低,越容易发生燃烧,白磷着火点低,相同条件下自磷比红磷易被点燃;
(3)与氧气接触面积越大,燃烧就越容易发生,如木炭粉比木炭在空气中燃烧得剧烈;故填:与氧气的接触面越大,燃烧越剧烈,如木炭粉比木炭在空气中燃烧得剧烈;
(4)可燃物越干燥,越容易被点燃,如梅雨天火柴不易被划着;故填:可燃物越干燥,越易点燃,如梅雨天火柴不易被划着.
点评 燃烧的条件是:物质具有可燃性、与空气接触、达到着火点,三个条件缺一不可.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 柠檬酸是由碳、氢、氧三种元素组成的 | |
| B. | 柠檬酸的相对分子质量为192 | |
| C. | 一个柠檬酸分子中含有6个碳原子、8个氢原子和7个氧原子 | |
| D. | 柠檬酸中,碳、氢、氧三种元素的质量比为6:8:7 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 钠原子的结构示意图中,x=10 | |
| B. | 在元素周期表中,钠元素的原子序数为11 | |
| C. | 在化学反应中,氯原子容易失去电子 | |
| D. | 氯化钠是由氯化钠离子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
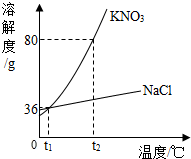
| A. | t1℃时,向分别盛有3.6g NaCl和KMO3固体的烧杯中各加入10g水,充分搅拌后两种固体能全部溶解 | |
| B. | t2℃时,NaCl和KMO3两种物质的饱和溶液都降温至t1℃,两种溶液中溶质的质量分数相等 | |
| C. | t2℃时,将100g KMO3饱和溶液降温到t1℃,会有44g晶体析出 | |
| D. | KMO3中含有少量NaCl,可以用冷却热饱和溶液的方法提纯KMO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com