
【题目】Ⅰ.高炉炼铁所需的原料有铁矿石、焦炭、石灰石等,其过程可用下图简要表示:
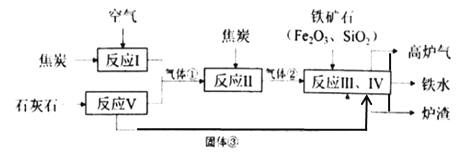
已知气体①、气体②和固体③均属于氧化物。
(1)气体②的化学式为______。根据氧化物的性质推测炉渣的主要成分为________(填化学式)。
(2)炼铁高炉底部通过不同高度的出口分离铁水与炉渣(如下图所示)。能实现渣铁分离的原因是因为炉渣具有_______________、____________的性质。

(3)反应Ⅰ~Ⅴ中属于化合反应的有___个,属于分解反应的有________个,属于置换反应的有_____个。
(4)高炉气中含有多种成分,其中含量最高(占55~60%)的是___(填化学式),此外还含有25~30%的可燃性气体_____(填化学式),以及9~12%左右的_____(填化学式)。
Ⅱ.有一包固体粉末,可能由CuSO4、CaCO3、Na2SO4中的一种或几种所组成.小文为了确定它的成分进行了如下实验:

(1)操作a的名称是______(填“蒸发”或“过滤”),其中必须要用到的玻璃仪器有烧杯、玻璃棒和________。
(2)写出蓝色沉淀的化学式:_________。
(3)白色固体是________,写出实验室检验CO2的化学方程式______________________。
(4)小文通过实验后认为,这包固体粉末中只有两种物质,他的判断是__________(填“正确”或“错误”)的,理由是________________________________。
【答案】 CO CaSiO3 熔点高 密度比铁水小 3个 1个 0个 N2 CO CO2 过滤 漏斗 Cu(OH)2 CaCO3 CO2 + Ca(OH)2 =CaCO3 ↓ +H2O 错误 无法判断是否含有Na2SO4
【解析】Ⅰ(1)根据二氧化碳气体与碳在高温下反应生成一氧化碳及氧化钙与二氧化硫反应生成硅酸钙解答;(2)根据炉渣出口位于铁水出口上方分析解答;(3)根据发生的反应分析解答;(4)根据空气的主要成分是氮气及反应生成的一氧化碳和二氧化碳分析解答;Ⅱ(1)根据结果操作a得到固体和液体两种状态的物质分析操作及需要的仪器;(2)根据蓝色沉淀是蓝色溶液和氢氧化钠反应产生的,可知含有硫酸铜,产生氢氧化铜蓝色沉淀;(3)根据物质溶于水得到白色沉淀,可知是原有的难溶性碳酸钙,没有两两反应产生的沉淀,故只有碳酸钙,二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水;(4)根据推断的物质一定含有碳酸钙、硫酸铜,可能含有硫酸钠分析。Ⅰ(1)二氧化碳气体与碳在高温下反应生成一氧化碳,故气体②的化学式为CO;石灰石分解生成的固体产物氧化钙与二氧化硅在高温的条件下反应生成硅酸钙,故炉渣的主要成分为CaSiO3;(2)炼铁高炉底部通过不同高度的出口分离铁水与炉渣。能实现渣铁分离的原因是因为炉渣具有熔点高、密度比铁水小的性质;(3)反应Ⅰ是碳与氧气反应生成二氧化碳,属于化合反应;反应Ⅱ是碳与二氧化碳反应生成一氧化碳,属于化合反应;反应Ⅲ、Ⅳ是一氧化碳与氧化铁在高温下反应生成铁和二氧化碳(不属于基本反应类型)及氧化钙与二氧化硅反应生成硅酸钙,属于化合反应;反应Ⅴ是碳酸钙在高温条件下反应生成氧化钙和二氧化碳,属于分解反应。故反应Ⅰ~Ⅴ中属于化合反应的有3个,属于分解反应的有1个,属于置换反应的有0个;(4)高炉气中含有多种成分,其中含量最高(占55~60%)的是N2,此外还含有25~30%的可燃性气体CO,以及9~12%左右的CO2;Ⅱ(1)结果操作a得到难溶性固体和蓝色溶液,可知是过滤,需要的仪器有:铁架台、烧杯、玻璃棒和漏斗,其中缺少的玻璃仪器是漏斗;(2)溶液呈现蓝色的是硫酸铜,和氢氧化钠反应产生的氢氧化铜是蓝色的沉淀,化学式为Cu(OH)2;(3)白色固体是难溶性的碳酸钙,化学式为CaCO3;二氧化碳与氢氧化钙溶液反应生成碳酸钙沉淀和水,故反应的化学方程式为CO2 + Ca(OH)2 =CaCO3 ↓ +H2O;(4)经过推断一定含有的物质是碳酸钙、硫酸铜,而硫酸钠不影响实验的现象,所以可能含有硫酸钠,因此认为这包固体粉末中只有两种物质的判断是错误的,因为无法判断是否含有Na2SO4。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:初中化学 来源: 题型:
【题目】下列实验操作,能达到预期目的是
①用托盘天平称取5.6gCuO粉末
②用10mL水和10mL酒精配制20mL酒精溶液
③将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,得到溶质质量分数为20%的盐酸
④用10mL的量筒取8.2mL水
A.①③④ B.①④ C.①②④ D.②③
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】自来水厂常用氯气杀菌消毒,用明矾、氯化铁等净化水。以硫铁矿(主要成分是FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的流程如图:
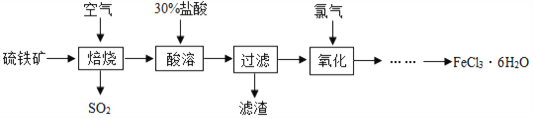
⑴已知“焙烧”阶段就是硫铁矿的燃烧,生成物是Fe2O3和SO2,写出该反应的化学方程式_________,硫铁矿进行燃烧前要将其粉碎,其目的是________。
⑵大量排放出的SO2能形成________,危害环境,可将含SO2的废气通入氨水中,氨水的pH____7,反应后生成的亚硫酸铵[(NH4)2SO3]在农业上可做________肥。实验室使用氢氧化钠溶液来吸收SO2(SO2 + 2NaOH = Na2SO3 + H2O)。现有6.4gSO2,至少需要10%的氢氧化钠溶液的质量是多少_______?(写出计算过程)
⑶①流程中用30%盐酸“酸溶”焙烧后的残渣,写出化学方程式_____________________。
②在“酸溶”时是否可以用硫酸代替盐酸?______(填“可以”或“不可以”),原因是_____。
③若在实验室欲用38%(密度为1.18 g/ml)的盐酸配制30%的盐酸,则需要的玻璃仪器有烧杯、胶头滴管、________、________等。
⑷实际上“焙烧”阶段很难做到将硫铁矿完全反应,因“酸溶”后的混合物中有FeCl2,将其在“氧化”阶段与氯气(Cl2)反应生成FeCl3,写出化学方程式_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像与所述实验相符的是
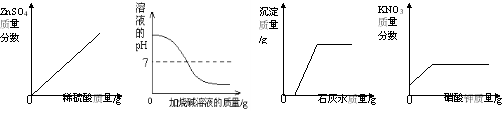
A B C D
A.向一定量锌粒中加入过量稀硫酸
B.向稀盐酸中滴加过量的烧碱溶液
C.向一定量氢氧化钠和碳酸钠的混合溶液中加入过量的石灰水
D.20℃时,向一定量不饱和的硝酸钾溶液中加入过量的硝酸钾晶体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下列装置图回答问题:
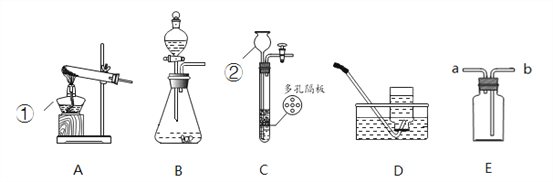
(1)写出仪器名称:①__________,②__________。
(2)用双氧水和二氧化锰制取氧气,可选用装置__________(选填序号)和D组合,化学方程式为__________,二氧化锰的作用是__________。
(3)鸡蛋壳的主要成分是碳酸钙,用鸡蛋壳与稀盐酸反应制CO2可用装置B或装置C,装置C相对于B的优点有__________。
(4)氨气(NH3)是一种无色有刺激性气味,密度比空气小,极易溶于水的气体。实验室用加热固体氯化铵和消石灰的混合物制取氨气(NH3),可选装置__________(选填序号),用E装置收集氨气,气体应从__________(选填“a”或“b”)端通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表是从物质分类的角度认识部分酸碱盐的反应规律。
①请完成下表
序 列 | 物质分类的角度 | 实例 | 化学方程式 | |
反应物 | 生成物 | |||
1 | 盐和碱 | 盐和碱 | 碳酸钠和氢氧化钡 | Na2CO3+Ba(OH)2→BaCO3↓+2NaOH |
2 | 酸和金属 | 盐和氢气 | 铁和稀硫酸 | _______________ |
3 | 盐和盐 | 盐和盐 | 硝酸银和________ | ________________ |
4 | 盐和金属 | 盐和金属 | 锌和硫酸铜溶液 | __________________ |
②表中属于复分解反应的有__个;“锌和硫酸铜溶液”反应中现象是_____。
③可见,生成盐的途径有多种。当生成物中有硫酸钠时,可以是硫酸和氢氧化钠的反应,也可以是______和_____(写出具体物质的名称或化学式,酸和碱反应除外)。
④除了表中所列,盐还能与______(填物质类别名称)反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液在生产、生活中起着十分重要的作用。
(1)可作为溶质的是_______。
A.只有固体 B. 只有液体
C.只有气体 D. 气体、液体、固体都可以
(2)物质加入足量水中,能形成无色透明溶液的是_______。
A.汽油 B. 面粉 C. 纯碱 D. 硫酸铜
(3)物质加入水中形成溶液过程中,温度会升高的是_______。
A.烧碱 B. 氯化钠 D. 氧化钙 D. 碳酸钙
(4)下表是NaCl和KNO3在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度g/100g水 | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | |
①两种物质中,溶解度受温度影响变化较大的是__________。
②NaCl和KNO3溶解度相等的温度范围是__________。
③KNO3晶体中含有少量NaCl,提纯KNO3晶体的方法是__________。
④60℃时,按图示操作:
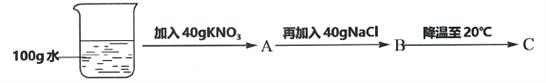
A中溶液是__________(填“饱和”或“不饱和”)溶液,C中溶液的总质量是__________g。
⑤50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,剩余溶液的质量:NaCl溶液__________(填“大于”“等于”或“小于”)KNO3溶液。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下化学新材料的应用,使人们的生活质量不断提高。下图是不同年代常用的水管。

(1)图示水管中,含有的金属元素是_________,含有的有机合成材料是_________。
(2)铸铁管容易生锈。工业上常用稀盐酸来除铁锈(Fe2O3),该反应的化学方程式________________。请你提出一种防止铁制品锈蚀的方法:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com