
【题目】化学兴趣小组做酸和碱的中和反应时,往NaOH溶液中滴入几滴酚酞溶液,发现溶液刚变
红瞬间又褪成无色。讨论并猜想。
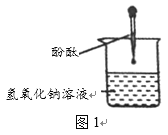
猜想一:可能是酚酞溶液变质
猜想二:可能与NaOH溶液的浓度有关
猜想三:可能是酚酞溶液在滴入过程中被O2氧化
……
(1)甲同学认为猜想一是不对的。其理由是_________________________。
(2)取3mL不同浓度的NaOH溶液,分别滴入3滴酚酞溶液,观察现象。得到NaOH溶液的浓度与酚酞溶液褪色时间关系如图2所示。
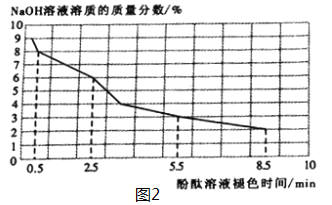
①根据图2所示,NaOH溶液溶质的质量分数________,酚酞溶液由红色褪为无色的时间越短。
②做酸和碱的中和反应时,滴加酚酞溶液的目的是________________________________。若用做实验的NaOH溶液溶质的质量分数为4%,完成该实验的操作时间应控制在_______之内。
(3)请设计实验,验证猜想三是否正确。
实验操作 | 实验现象 | 实验结论 |
__________ | 5.5min酚酞溶液褪色 | 酚酞溶液先变红后褪色与O2_______ (选填“有关”或“无关”) |
(4)探究酸碱中和反应时,逐滴加入稀盐酸的过程,并不断搅拌的目是_________________,写出该反应的化学方程式___________________________。
【答案】如果酚酞溶液已经变质,遇到NaOH溶液就不可能有先变红的现象 越大 便于观察反应发生及反应完全(或反应终点) 3.5 min 取3mL3%NaOH溶液于试管中,加热煮沸后,在液面上方滴加植物油,然后在冷却到室温后的下方溶液中滴入3滴酚酞溶液,轻轻振荡 无关 加快反应速率(使反应充分进行) NaOH+HC1=NaCl+H2O
【解析】
(1)甲同学认为猜想一是不对的。其理由是如果酚酞溶液已经变质,遇到NaOH溶液就不可能有先变红的现象;
(2)①根据图2所示,NaOH溶液溶质的质量分数越大,酚酞溶液由红色褪为无色的时间越短。
②由于氢氧化钠与盐酸反应没有明显的实验现象,酚酞遇碱性物质变红色,可利用氢氧化钠被消耗来指示反应是否发生,酚酞刚刚变成无色时,酸、碱恰好完全反应。做酸和碱的中和反应时,滴加酚酞溶液的目的是便于观察反应发生及反应完全(或反应终点);根据图2所示,若用做实验的NaOH溶液溶质的质量分数为4%,完成该实验的操作时间应控制在3.5 min之内;
(3)5.5min酚酞溶液褪色,根据图2可知,需3%的氢氧化钠进行实验,为了探究酚酞溶液先变红后褪色与O2是否有关,需将实验与氧气隔绝进行对比,可将溶液加热煮沸后,滴入植物油,冷却到室温后进行实验。因此:
实验操作 | 实验现象 | 实验结论 |
取3mL3%NaOH溶液于试管中,加热煮沸后,在液面上方滴加植物油,然后在冷却到室温后的下方溶液中滴入3滴酚酞溶液,轻轻振荡 | 5.5min酚酞溶液褪色 | 酚酞溶液先变红后褪色与O2 无关 |
(4)探究酸碱中和反应时,逐滴加入稀盐酸的过程,并不断搅拌的目是加快反应速率(使反应充分进行),氢氧化钠与盐酸反应生成氯化钠和水,该反应的化学方程式为:NaOH+HC1=NaCl+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】化学实验操作的规范性、安全性是实验成败的关键,同时也反映了实验者的化学素养。下列实验操作中正确的是( )
A.  过滤B.
过滤B.  测定空气中氧气含量
测定空气中氧气含量
C.  贮存氧气D.
贮存氧气D. 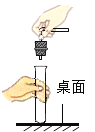 塞紧胶塞
塞紧胶塞
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化钡是一种可溶性重金属盐,广泛应用于化工领域。工业上以重晶石(主要成分BaSO4,杂质为Fe2O3)为原料,通过下列流程生成氯化钡晶体(BaCl2·xH2O)并进行组成测定。
已知:①BaSO4+4C![]() 4CO↑+BaS
4CO↑+BaS
②CaO、BaO都能与水反应生成碱
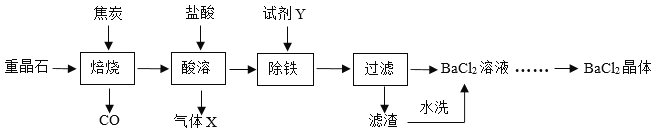
(1)焙烧时,焦炭与杂质Fe2O3也会发生反应,反应方程式为_____;实际生产中必须加入过量焦炭,其目的是使重晶石充分反应,提高产率和_____。
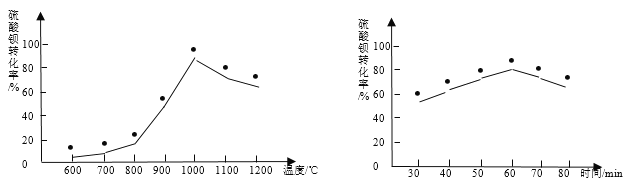
(2)焙烧时,温度和时间对硫酸钡转化率的影响如下图,则最佳温度约为_____℃,时间约为_____min。
(3)酸溶时,硫化钡(BaS)与盐酸发生复分解反应产生硫化氢气体(H2S),该反应方程式为_____;气体X成分除H2S和少量挥发出的HCl、水蒸气外,还含有_____。
(4)除铁反应中试剂Y可以是_____(填字母)。
a.NaOH溶液 b.氨水 c.生石灰 d.BaO固体
证明铁已除尽的方法是:取上层清液于试管中,滴入_____溶液,若无明显现象,则已除尽。
(5)滤渣水洗的目的是提高晶体产率和_____。
(6)测定晶体(BaCl2·xH2O)的组成:
Ⅰ.称取24.4gBaCl2晶体,置于小烧杯中,加入适量蒸馏水,使其全部溶解。
Ⅱ.再边搅拌边滴加稀硫酸到沉淀完全,静置;
Ⅲ.过滤并洗涤沉淀;
Ⅳ.将盛有沉淀的滤纸包烘干并中温灼烧后,称得BaSO4沉淀质量为23.3g。
①通过计算,确定x的值。_____(写出计算过程)
②操作Ⅳ中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果_____(填“偏低”、“偏高”或“不变”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组为探究实验室内一瓶久置的氢氧化钠溶液是否变质,三位同学分别选择了三类不同的物质进行实验
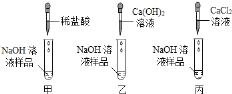
①观察到甲实验_____的现象,证明样品已变质。
②写出进行乙实验时应发生反应的化学方程式_____。
③请你在丙实验的基础上,设计实验方案,证明已经变质的样品中还含有氢氧化钠。_____。
④由上述实验可知,氢氧化钠必须_____保存。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是( )
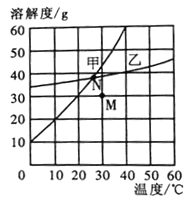
A. 40℃时,甲物质饱和溶液溶质的质量分数为60%
B. N点状态的甲、乙两种溶液中溶质的质量相等
C. 当乙中含有少量的甲,可用降温结晶法提纯乙
D. M点状态的甲溶液通过降温并加入甲物质可转化为N点状态
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】a、b两物质的溶解度曲线如图1所示,请根据图回答:
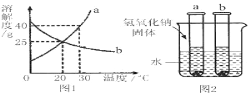
(1)30℃时,a的溶解度是____g。
(2)a的溶解度小于b的溶解度的温度范围是_________。
(3)如图2所示,现有20℃时等质量的a、b两物质的饱和溶液,试管底部有等质量的a、b剩余,向烧杯的水中加入氢氧化钠固体,则对相关变化判断正确的是____(不考虑溶剂的蒸发,析出的固体不含水)
A a溶液中溶质质量增多,b溶液中溶质质量减少
B a溶液中溶质质量分数小于b溶液中溶质质量分数
C a溶液中溶剂质量小于b溶液中溶剂质量
D 试管底部a固体的质量小于b固体的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业用盐,有毒、有咸味,外形与食盐相似。下图是NaNO2、NaCl 的溶解度曲线。请回答下列问题:
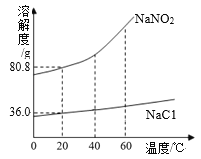
(1)根据溶解度曲线,某同学设计了鉴别 NaNO2、NaCl 固体的方案,如上图:
①由此可以判断甲是___(填化学式);
②m的取值范围为____。
(2)现有一杯125.0g溶质质量分数为20%的NaNO2溶液,若维持温度在20℃,要使该溶液变为饱和溶液,需要加入NaNO2固体____g。
(3)根据溶解度曲线,关于NaNO2和NaCl下列说法中正确的是____。
A 20℃时,等质量的两种固体加水配成饱和溶液,所得NaCl溶液的质量大
B 40℃时,NaNO2溶液的溶质质量分数大于NaCl溶液的溶质质量分数
C 60℃时,两种物质的饱和溶液降温到 20℃时,NaNO2的溶液中析出晶体较多
D 除去NaNO2固体中混有的少量NaCl,可以采用降温结晶的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从Ca、C、S、H、O、N六种元素中选择适当的元素按要求填空.
①人体中元素含量最高的是_____;
②常用作干燥剂的一种酸_____;(填化学式,下同).
③能作为燃料的化合物是_____;
④既可用来消毒杀菌,又可用来改良酸性土壤的碱是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】竹子是“有节、中空、四季常绿”的植物(如图1所示),同学们对竹子中的气体成分展开了探究,测定其成分。

图1
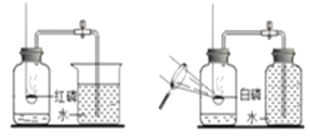
方案一 方案二
图2
(1)收集竹子中的气体。
小华提出:将一节竹子浸没在水中,在竹子上钻孔,用排水法收集气体。
小刚提出:可用注射器从竹子中抽取气体。
大家认为两人的想法都可行,于是分为A、B两组,在相同的条件下,A组采用小华的取气方法,B组采用小刚的取气方法,分别完成下面的实验。
(2)检验气体中是否含有二氧化碳气体。
实验步骤 | 实验现象 | 实验结论及解释 |
向所取气体中加入______ | _____ | 有二氧化碳。 |
(3)测定氧气含量。
(查阅资料)红磷的着火点为240℃,白磷的着火点为40℃。
(设计实验)同学们设计了如图2所示的方案一和方案二来测定氧气含量。
(进行实验)按上述两个方案进行多次实验。
a.实验中磷的量应为足量,原因是_____。
b.方案一中发生反应的化学方程式为_____。
(反思与评价)
c.经过A、B两组同学分别根据方案一、二实验,A组测得的含氧量总是大于B组的,你认为原因是_____。
注意:若答对以下两小题将奖励4分,但化学试卷总分不超过60分
(4)a.上述实验方案_____(填“能”或“不能”)准确测定竹节内氧气含量,为什么?_____。(每空1分)
b.为准确测定竹节中氧气的含量,同学们查阅资料,利用氧气传感器对实验做了改进(如图3所示),最终得到图4图象。
观察图4,你可以获得哪些信息:
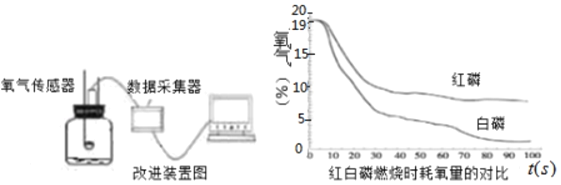
图3 图4
Ⅰ_____;Ⅱ_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com