
有一包固体,可能由氯化铜、硫酸钠、氯化钠、碳酸氢钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展以下实验: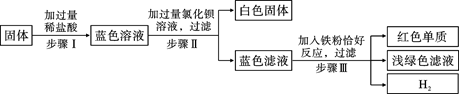
已知,步骤Ⅰ中固体全部消失,溶液呈蓝色,无气泡产生。请回答下列问题
(1)原固体中一定含有的物质是___________;
(2)原固体中一定不含有的物质是___________,证据是___________;
(3)任写一个步骤Ⅲ中发生反应的化学方程式___________
(4)步骤Ⅲ所得浅绿色滤液中一定含有的溶质是___________。
⑴氯化铜、硫酸钠;⑵碳酸氢钠或NaHCO3,向固体中加入过量稀盐酸时,无气泡产生(或步骤1中未观察到气泡产生);⑶写出铁与氯化铜或稀盐酸反应的化学方程式即可;⑷氯化亚铁、氯化钠、氯化钡或写化学式。
解析试题分析:(1)固体物质溶于水后显蓝色,可知有铜离子,所以一定含有氯化铜,在盐酸过量的情况下加入过量氯化钡,有白色沉淀生成,说明原固体物质含有硫酸根离子,说明还含有硫酸钠;(2)向固体中加入过量稀盐酸时,无气泡产生,说明不含有碳酸氢钠;(3)步骤Ⅲ中发生两个反应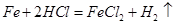 、
、 。
。
考点:物质组成的推断
点评:对于常见化学物质的鉴别和推断属于中考的必考点,选择填空均可出题,考察形式较为灵活,注意积累总结。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:初中化学 来源: 题型:
| 实验步骤 | 观察现象 | 对应的推理和分析 |
| ①向混合物中加入适量水 | 全部溶解,溶液 无色透明 |
①一定没有 BaSO4 BaSO4 |
| ②向步骤①溶液中滴加过量BaCl2溶液 | 白色沉淀 | ②可能有 K2SO4、Na2CO3 K2SO4、Na2CO3 |
| ③取步骤②的白色沉淀,加入稀盐酸 | 白色沉淀全部消失 | ③一定有 Na2CO3 Na2CO3 |
| ④在步骤②的浊液中滴加 过量AgNO3溶液和稀HNO3 |
白色沉淀 | ④一定有NaCl和CaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com