一定质量的A溶液和111g氯化钙溶液恰好完全反应,生成白色沉淀B.化学方程式为:A+CaCl2═B↓+2NaCl.
(1)A的化学式为______.
(2)滤出沉淀B,再烘干,称量得10g,则CaCl2溶液中溶质的质量分数为多少?
【答案】
分析:题综合性比较强,第一问可根据质量守恒定律和复分解反应的特征来解答.在(2)中要求先会写出:A+CaCl
2═B↓+2NaCl的真正的化学方程式即 Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl然后根据题中的信息求出CaCl
2溶液的溶质质量.进而便可求出氯化钙溶液的溶质质量分数.
解答:解:(1)根据复分解反应的特征A物质必定含有的金属元素是钠,B是一种含钙的沉淀,常见的钙的沉淀是碳酸钙,所以A是碳酸钠,带入方程式该方程式为Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl,与A+CaCl
2═B↓+2NaCl的特征正好符合;
(2)设111g氯化钙溶液中含有的氯化钙质量是x
Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl
111 100
x 10g
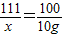
x=11.1g
则CaCl
2溶液中溶质的质量分数为
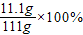
=10%
故答案为:(1)CaCO
3 (2)答:CaCl
2溶液中溶质的质量分数为10%.
点评:本题是一道综合性比较强的试题,要求学生要掌握复分解反应的特征、以及能根据化学方程式进行计算、并利用所给的质量会求溶液中溶质质量分数.

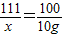
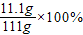 =10%
=10%

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案