
100克某浓度的硫酸恰好与13克的锌完全起反应。请计算:
⑴生成氢气的质量(结果精确到0.1g);
⑵将⑴的结果标在图中;
⑶反应后所得溶液中溶质的质量分数(写出计算过程,结果精确到0.1%).
【答案】解:设生成氢气的质量为x,生成硫酸锌的质量为y。
Zn + H2SO4 = ZnSO4 + H2↑ ……………………(1分)
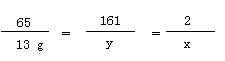
65 161 2
13g y x ……………………(1分)
x = 0.4 g ………………………(1分)
y = 32. 2 g ………………………(1 分)
分)

硫酸锌的质量分数 = ×100%
= 28.6% ………………………(1分)
 |
…………………(1分)
答:生成0.4克的氢气,同时硫酸锌溶液的质量分数为28.6%。
【解析】由完全反应的金属锌的质量可以求出生成的氢气和反应后所得溶液中溶质质量,溶液质量为加入的两种物质减去生成的气体(逸出),即100g + 13g -0.4g。


科目:初中化学 来源: 题型:
超临界流体是物质介于气态和液态之间的新状态,目前应用最广泛的是超临界二氧化碳,它在化学工业上可取代氟利昂作溶剂等.下列有关超临界二氧化碳的说法中不正确的是( )
A.超临界二氧化碳是合成的一种新物质
B.超临界二氧化碳是由CO2分子构成的
C.超临界二氧化碳溶解某些物质后,二氧化碳可在常温常压下完全挥发
D.用超临界二氧化碳代替氟利昂,可减轻大量使用氟利昂对大气臭氧层造成的破坏
查看答案和解析>>
科目:初中化学 来源: 题型:
现有锌和另一种金属组成的合金6.5g,洋洋同学向此合金中加入100g一定溶质质量分数的稀盐酸,充分反应后,发现金属完全消失,若产生氢气的质量为m。则下列判断正确的是
A.如果合金为锌和铁,m不可能是0.2g
B.反应后溶液中的溶质只有两种
C.如果合金为锌和镁,m可能是0.1g,则该合金中锌的质量分数为50%
D.如果合金为锌和铁,所加稀盐酸溶质质量分数一定大于7.3%
查看答案和解析>>
科目:初中化学 来源: 题型:
在实验室里加热25g混有二氧化锰的氯酸钾固体混合物制取氧气,完全反应后剩余固体质量为15.4g。请计算
(1)生成氧气的质量为 g。
(2)反应前固体混合物中氯酸钾的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
| 次 数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 8.5 | 7 | 6.6 | 6.6 |
(1)铜镁合金中铜的质量。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
为测定某CuSO4溶液的溶质质量分数,化学小组的同学取CuSO4溶液100g,向其中滴加一定浓度的NaOH溶液,至不再产生沉淀为止,共用去NaOH溶液80g,过滤,得到滤液175.1g.请计算:
(1)该反应生成沉淀 _____g;
(2)该CuSO4溶液中溶质的质量分数.
(温馨提示:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4)
查看答案和解析>>
科目:初中化学 来源: 题型:
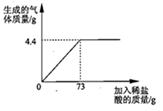 某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图
某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图
(1)纯碱恰好完全反应时,生成CO2的质量为 g
(2)计算该样品中含杂质的质量分数 是多少?(计算结果保留一位小数,下同)
是多少?(计算结果保留一位小数,下同)
(3)计算当盐酸与纯 碱恰好完全反应时,所得溶液的溶质质量分数是多少?
碱恰好完全反应时,所得溶液的溶质质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
同学们做甲、乙两个中和反应实验的探究(见下图)。
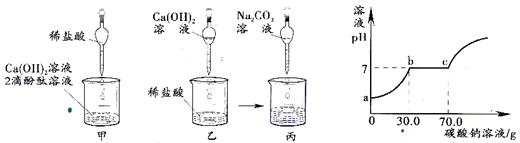
题25-1图 题25-2图
(1)甲实验恰好中和,则该溶液中的溶质是 (填化学式)。
(2)取乙反应后的溶液60.0g,滴加质量分数26.5%的Na2C03溶液(见丙图),溶液pH的变化如题25-2图所示。则与CaCl2反应的碳酸钠溶液的质量为 g;请计算该 溶液中CaCl2的溶质质量分数(写出计算过程,精确到0.1%)。
(3)根据计算所得数据在题25-3图中画出产生沉淀的曲线。
(4)乙组的中和反应实验设计存在的不足是 。
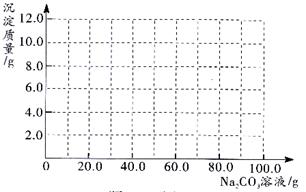
题25-3图
查看答案和解析>>
科目:初中化学 来源: 题型:
 某同学为了测定一种补钙保健食品中CaCO3的质量分数,(其包装说明如下图所示)进行了如下实验:将100片该食品研碎后放入一烧杯中,向其中慢慢滴加稀盐酸,直到不再产生气泡时,共消耗稀盐酸200g,(该保健食品中其它成分不与盐酸反应)并测得烧杯内剩余物质的总质量为232.4g.请你根据以上数据计算:
某同学为了测定一种补钙保健食品中CaCO3的质量分数,(其包装说明如下图所示)进行了如下实验:将100片该食品研碎后放入一烧杯中,向其中慢慢滴加稀盐酸,直到不再产生气泡时,共消耗稀盐酸200g,(该保健食品中其它成分不与盐酸反应)并测得烧杯内剩余物质的总质量为232.4g.请你根据以上数据计算:
(1)所用盐酸的溶质质量分数
(2)该保健食品中CaCO3的质量分数为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com