
科目:初中化学 来源: 题型:阅读理解
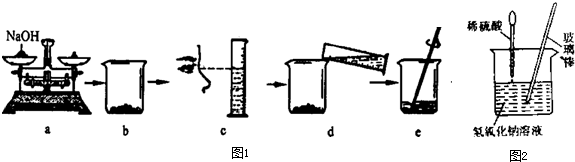
| 实验 | 实验操作 | 实验现象 | 实验结论 |
| 甲 | 两种物质已恰好完全中和 | ||
| 乙 | 第二种可能性 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
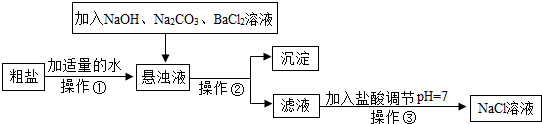

| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2010?白下区一模)利用中和反应可以测定酸(或碱)溶液的溶质质量分数.例如,在一定质量的待测酸溶液中逐滴滴入已知溶质质量分数的碱溶液,直到酸、碱恰好完全反应,根据消耗碱溶液的质量即可计算出待测酸溶液的溶质质量分数.反之亦然.右图为某次测定过程中,溶液的pH随所滴加溶液质量的变化而变化的关系图.请根据图中信息,解答下列问题.
(2010?白下区一模)利用中和反应可以测定酸(或碱)溶液的溶质质量分数.例如,在一定质量的待测酸溶液中逐滴滴入已知溶质质量分数的碱溶液,直到酸、碱恰好完全反应,根据消耗碱溶液的质量即可计算出待测酸溶液的溶质质量分数.反之亦然.右图为某次测定过程中,溶液的pH随所滴加溶液质量的变化而变化的关系图.请根据图中信息,解答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
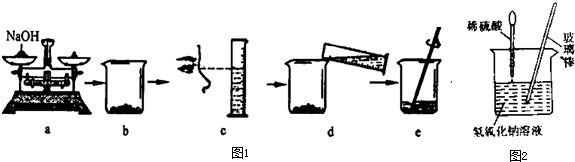
| 实验 | 实验操作 | 实验现象 | 实验结论 |
| 甲 | 两种物质已恰好完全中和 | ||
| 乙 | 第二种可能性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com