
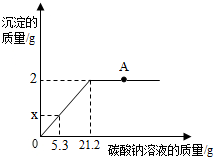
 某盐场生产的食盐产品中含有氯化钙杂质,某化学兴趣小组为测定该食品产品中氯化钠的质量分数,进行了如下实验:取100g食盐样品完全溶解于水,逐渐加入碳酸钠溶液,反应关系如图所示:
某盐场生产的食盐产品中含有氯化钙杂质,某化学兴趣小组为测定该食品产品中氯化钠的质量分数,进行了如下实验:取100g食盐样品完全溶解于水,逐渐加入碳酸钠溶液,反应关系如图所示:分析 由图象可知,当生成沉淀的质量为2g时,食盐中的氯化钙恰好完全反应,根据此时沉淀的质量可求得氯化钙的质量.根据消耗的碳酸钠溶液质量与生成沉淀的质量成正比例关系,可求加入5.3克碳酸钠溶液时所生成沉淀的质量.
解答 解:(1)氯化钠与碳酸钠不反应,所以发生反应的方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl.当生成2g沉淀时,消耗碳酸钠溶液21.2g,按比例关系,则有:$\frac{21.2g}{2g}=\frac{5.3g}{x}$ x=0.5g
(2)由图象可知,当生成沉淀的质量为2g时,食盐中的氯化钙恰好完全反应,A点时,碳酸钠过量,图中A点对应溶液中的溶质是氯化钠和碳酸钠;
(3)设食盐产品中氯化钙的质量为y,则
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
y 2g
$\frac{111}{y}=\frac{100}{2g}$
y=2.22g
该食盐产品中氯化钠的质量分数=$\frac{100g-2.22g}{100g}×$100%=97.8%
答案:
(1)0.5g
(2)NaCl、Na2CO3
(3)该食盐产品中氯化钠的质量分数是97.8%.
点评 对于带有图象或图表的计算题,在近年的中考中出现频度较高,能对图象或图表进行分析得出所需信息是解题的关键.


科目:初中化学 来源: 题型:选择题
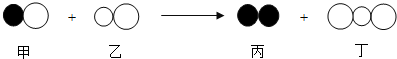
| A. | 反应前后,原子种类、数目不变 | |
| B. | 该反应中的甲、乙、丙、丁四种物质的分子个数比为2:2:1:2 | |
| C. | 该反应是置换反应 | |
| D. | 反应物和生成物都是由分子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 家用电器着火时,立即用水扑灭 | |
| B. | 发现煤气泄漏时,立即打开排气扇电源开关 | |
| C. | 高层住房着火时,立即打开所有门窗 | |
| D. | 炒菜时油锅着火,立即盖上锅盖 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
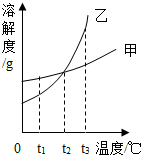 如图甲、乙两物质的溶解度曲线,下列说法中正确的是( )
如图甲、乙两物质的溶解度曲线,下列说法中正确的是( )| A. | 若将t1℃时的甲、乙的饱和溶液升温至t2℃时,甲、乙溶液中溶质的质量分数相等 | |
| B. | 若将t3℃时的甲、乙的饱和溶液降温至t2℃时,甲、乙两溶液中均有晶体析出 | |
| C. | t2℃时,甲、乙的饱和溶液和溶液中含有的溶质质量甲大于乙 | |
| D. | 当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
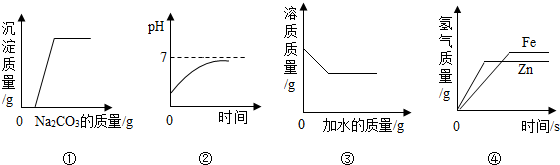
| A. | 图①是向一定量稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量 | |
| B. | 图②是向稀盐酸中逐渐加水稀释 | |
| C. | 图③是向饱和的NaCl溶液中不断加水 | |
| D. | 图④是用等质量的锌、铁与足量的稀硫酸反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
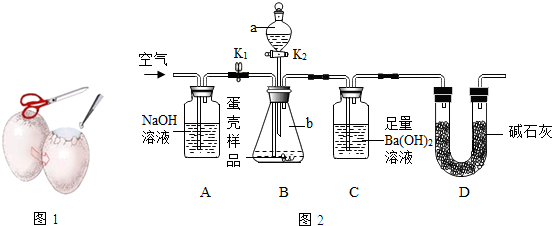
| 实验次数 | 实验1 | 实验2 | 实验3 |
| 装置C中沉淀质量(g) | 19.68 | 19.75 | 19.67 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
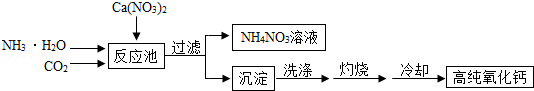
| A. | 过滤后所得沉淀表面一定含有的可溶性杂质是NH4NO3 | |
| B. | 冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有杂质Ca(OH)2 | |
| C. | 制备高纯氧化钙的工艺流程中生成的沉淀是CaCO3 | |
| D. | 该工艺流程中可以循环使用的物质有NH4NO3和CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com