
分析 (1)根据金属的性质进行分析解答,金属具有延展性;
(2)铁在空气中锈蚀的原理是铁与水和空气同时反应的结果;铁锈的主要成分是氧化铁,氧化铁与稀盐酸反应生成氯化铁和水;
(3)利用金属活动性顺序来解决此题.
解答 解:(1)铜可以拉成铜丝,这是利用金属的延展性;故填:延展性;
(2)铁在空气中锈蚀,实际上是铁跟空气中的氧气、水蒸气等物质相互作用的结果,防锈的方法使其与氧气隔绝,可涂保护膜或涂油.盐酸能与钢铁制品表面的铁锈(主要成分氧化铁)反应生成氯化铁和水,反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O;故填:空气中的氧气和水;刷油漆;Fe2O3+6HCl=2FeCl3+3H2O;
(3)根据金属活动性顺序,可知活动性:镁>铜>银,因为过滤后往滤渣中加盐酸,铜、镁、银中只有铁能和盐酸反应放出气泡,所以滤渣中一定有镁,故滤出的固体必有镁、铜和银,因为镁会与硝酸银和硝酸铜反应,置换出其中的银与铜,所以滤液中就不能再有硝酸银和硝酸铜了,只有硝酸镁.
故填:镁、铜和银;硝酸银和硝酸铜.
点评 此题综合性较强,主要考查了金属的物理性质和化学性质,是一道不错的题目.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用过氧化氢溶液制氧气 | B. | 溶解食盐固体 | ||
| C. | 过滤浑浊液 | D. | 检验某溶液的pH值 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
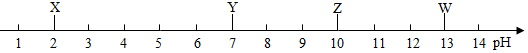
| A. | X一定显酸性 | B. | Y一定是水 | ||
| C. | Z不一定是碱溶液 | D. | W的碱性一定比Z强 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Ba(OH)2、NaCl、Na2SO4、Na2CO3 | B. | NaCl、BaCl2、CuSO4、NaOH | ||
| C. | NaOH、Ca(OH)2、H2SO4、K2CO3 | D. | KNO3、HCl、Na2CO3、BaCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
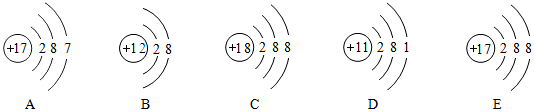
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
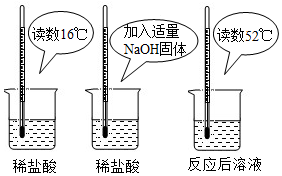
| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
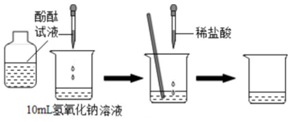
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com