
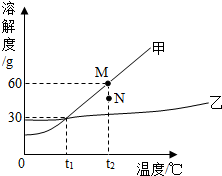
 如图为甲﹑乙两物质的溶解度曲线.下列说法不正确的是( )
如图为甲﹑乙两物质的溶解度曲线.下列说法不正确的是( )| A. | 甲的溶解度受温度变化影响比乙大 | |
| B. | t1℃时,甲、乙两物质饱和溶液中溶质的质量分数相同 | |
| C. | 要使组成在N点的甲溶液转变为M点的甲溶液,可以采用升高温度的方法 | |
| D. | 乙采用蒸发溶剂的方法得到乙晶体 |
分析 A、据溶解度曲线可知物质的溶解度随温度变化情况;
B、据饱和溶液中溶质的质量分数计算方法结合曲线图分析解答;
C、若要将组成N点的甲溶液转变为M点的甲溶液,可以采用的方法是:加甲物质;
D、乙的溶解度受温度影响不大,所以要得到乙晶体,可采取蒸发溶剂的方法.
解答 解:A、由图可知:甲的溶解度受温度影响比乙大,正确;
B、饱和时质量分数的计算式$\frac{溶解度}{溶解度+100g}$×100%,t1℃时,甲、乙两物质的溶解度相等,则饱和溶液中溶质的质量分数相同,正确;
C、M点的甲的饱和溶液,N点是甲的不饱和溶液,若要将组成在N点的甲溶液转变为M点的甲溶液,二者在同一温度下,可以采用温度不变,增加溶质的方法,故选项错误;
D、乙的溶解度受温度影响不大,所以要得到乙晶体,可采取蒸发溶剂的方法乙,正确;
故选:C.
点评 物质的溶解度是物质溶解能力的外在表现,因此要学会观察物质的溶解度曲线,为正确分析相关方面的问题奠定基础.


科目:初中化学 来源: 题型:实验探究题
| 步骤 | 具体操作 | 实验图示 |
| 步骤1 | 用盛有较浓氢氧化钠溶液的水槽、无底的废广口瓶、燃烧匙、橡皮塞等装配成如图的装置,放置良久.另准备一个有一根铜丝穿过的橡皮塞,铜丝末端固定一个足量的镁条. | 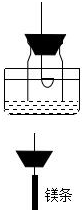 |
| 步骤2 | 引燃燃烧匙中足量的红磷,塞好橡皮塞.待充分冷却,观察到广口瓶内水面上升的体积约占瓶内水面原上方空间的五分之一左右. | |
| 步骤3 | 往水槽中加水使无底的废广口瓶内外水面相平.点燃镁条,迅速更换橡皮塞,镁条在广口瓶内继续燃烧,发出红光,放出热量.带冷却后广口瓶内水位继续上升约至瓶满. | |
| 步骤4 | 收集一瓶纯净的二氧化碳气体,同样用绑有镁条的橡皮塞,点燃镁条后将橡皮塞塞紧,看到镁条在二氧化碳中剧烈燃烧;用湿布不断擦拭集气瓶外壁,实验结束后,看到集气瓶内壁附着一层白色物质,中间还夹杂着一些小黑点. |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
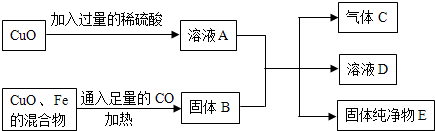
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
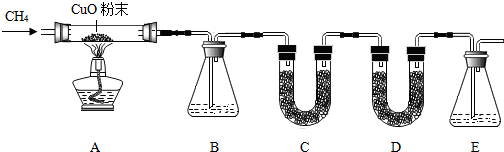
| A中玻璃管及物质总质量/g | B装置及物质总质量/g | D装置及物质总质量/g | |
| 反应前 | 108.0 | 212.0 | 131.0 |
| 反应后 | 106.4 | 212.9 | 132.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
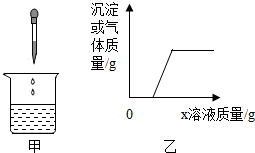 向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )
向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )| 烧杯中的物质 | x溶液 | |
| ① | 稀盐酸和硫酸铜 | 烧碱 |
| ② | 稀硫酸和稀盐酸 | 氯化钡 |
| ③ | 镁铝合金 | 稀盐酸 |
| ④ | 氯化钠和碳酸钠溶液 | 稀盐酸 |
| A. | ①④ | B. | ①③④ | C. | ①② | D. | ① |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 甲、乙、丙三种固体物质的溶解度曲线如图所示.
甲、乙、丙三种固体物质的溶解度曲线如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
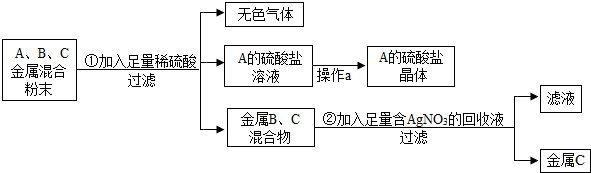
| A. | ②③④ | B. | ①②③ | C. | ②③④⑤ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com