
元素及其化合物知识是化学研究和学习的重要内容。
(1)氯化钠、氯化钙和氯化镁中都含有氯元素,下图是氯在元素周期表中的相关信息,下列说法不正确的是 (填标号)。

| A.该元素属于非金属元素 |
| B.该原子核内质子数为17 |
| C.该元素的原子形成阴离子后,离子结构示意图为 |
| D.该元素的相对原子质量为35.45g |
(1) D (2) Na+、Cl-- (3) 2NaHCO3△Na2CO3 + H2O + CO2↑
(4) ①肯定含有Na2CO3;可能含有NaOH
② 取少量(I)的溶液,加入足量BaCl2溶液(或CaCl2溶液),静置,取上层清液滴加酚酞溶液(或用pH试纸测定pH)
(5)79.5%
解析试题分析:(1)A、该元素名称的偏旁部首是“气字头”属于非金属元素,正确,B、该原子核内质子数为17,正确,C、该元素的原子做外层电子数为7,所以容易得到1个电子,形成阴离子,正确,D、该元素的相对原子质量为35.45,单位不是g,正确
(2)汗水含有的某物质有咸味,是由于汗液中含有氯化钠,是由离子构成的,构成该物质的微粒是:Na+、Cl--
(3)碳酸氢钠在焙制糕点和炸油条时常用作发泡剂,是因为碳酸氢钠受热易分解,发生的化学方程式是:2NaHCO3△Na2CO3 + H2O + CO2↑
(4)这是一个实验推断题,应紧紧跟住实验的过程,抓住实验过程中的现象进行分析,实验:(I)取一定量白色粉末,加入足量水,振荡,得到无色透明溶液,说明一点不含CuSO4,因为CuSO4的水溶液显蓝色,同时BaCl2和Na2CO3不能共存,因为会形成白色沉淀,而实验中没有这个现象,(Ⅱ)取少量(I)的溶液,加入足量盐酸,有气泡产生,说明一定含Na2CO3,则一定不含BaCl2
①该白色粉末中肯定含有含有Na2CO3;可能含有NaOH
②要确定NaOH是否存在,检验的实验步骤:取少量(I)的溶液,加入足量BaCl2溶液(或CaCl2溶液),静置,取上层清液滴加酚酞溶液(或用pH试纸测定pH),不能直接来检验NaOH是否存在,因为Na2CO3的水溶液也呈碱性
(5)根据反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑中Na2CO3与CO2质量关系,可算出Na2CO3的质量,进而算出食用纯碱中碳酸钠的质量分数
解:设Na2CO3的质量为x
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 44
x 6.6g
106/44="==" x/ 6.6g x="=15.9" g
碳酸钠的质量分数为:15.9 / 20×100%===79.5%
考点:核外电子的排布知识,元素周期表方格的信息,构成物质的微粒,实验推断题,根据化学方程式计算


科目:初中化学 来源: 题型:填空题
阿斯匹林的主要成分是乙酰水杨酸(化学式为C3H2O4),具有抑制血小板发挥作用的功能,是治疗心血管疾病的重要药物之一.
(1)乙酰水杨酸中氢、氧两种元素的质量比为
(2)乙酰水杨酸具有酸性,若在其无色溶液中滴入紫色石蕊试液,观察到溶液呈 色.
(3)人体内的血小板有何作用? 。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
黄铜是铜和锌的合金,某化学兴趣小组的同学在测定黄铜中铜的含量时,取黄铜样品40g,放入烧杯中,向其中加入200g稀硫酸,恰好完全反应,反应后烧杯中剩余物的总质量为239.6g,请计算
①产生氢气的质量是 ;
②参与反应的稀硫酸的质量是 ;
③黄铜中铜的质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(5分)将8.0 g氢氧化钠完全溶于水形成溶液,向其中加入一定质量的硫酸铜溶液,恰好完全反应,所得混合物总质量为109.8 g。计算:
(1)反应产生沉淀的质量。
(2)反应后所得溶液的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
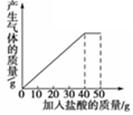
石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 10 | 10 | 10 |
| 剩余固体的质量/g | 16 | 12 | 8 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(14分)化学是研究物质的组成、结构、性质及变化规律的科学。
(1)①铜、②干冰、③氯化钠三种物质中,由离子构成的是 (填写序号,下同),可用于人工降雨的是 。
(2)食醋中含有醋酸(CH3COOH),醋酸由 种元素组成,其分子中氢、氧原子个数比为 。
(3)气体A和气体B接触可发生反应,生成固体C和液体D,其微观过程如下所示。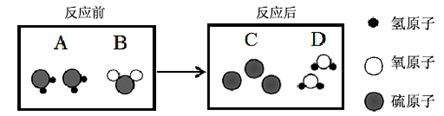
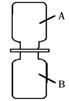
图1 图2
① 该反应过程中,属于氧化物的是 (填名称)。
② 将等体积的两只集气瓶中分别盛满A、B,如图2所示进行实验。已知相同条件下,气体的体积比等于分子个数比, 则充分反应后,剩余的气体是 (填化学式)。
(4)造纸会产生大量含NaOH的碱性废水,需经处理呈中性后排放。
① 用pH试纸检测废水呈碱性的方法是 。
② 若某造纸厂废水中含NaOH的质量分数为l.6%,现有废硫酸9.8t(H2SO4的质量分数为20%),可以处理的废水质量是多少?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(4分)我国约在南北朝时就开始炼制黄铜,黄铜是铜和锌的合金,它可用来制造机器、电器零件及日用品,为了测定某黄铜中铜的质量分数,取10g黄铜加入到50g稀硫酸中,恰好完全反应,产生氢气0.1g,试求:
(1)该黄铜样品中铜的质量分数。
(2)原稀硫酸溶液中溶质的质量分数。
(温馨提示:解答时,要有必要的文字说明和计算步骤等,只写最后结果不给分)
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
某碳酸钾溶液中,碳酸根与水分子数之比为1:100,向该溶液中通入足量二氧化碳,碳酸钾跟水和二氧化碳反应全部转变为碳酸氢钾,此碳酸氢钾溶液的溶质质量分数为
| A.5.26% | B.5.56% | C.7.13% | D.10.0% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com