
【题目】请从微观角度分析下列现象
(1)使用体温计测体温。________
(2)古代字画能够保存很长时间不褪色________。
(3)盐酸和碳酸钠反应前后质量不等为什么遵守质量守恒定律________?
 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:
【题目】铜是生活中常见的一种金属,在生活、生产中有广泛的应用。

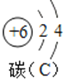
(1)如图为铜元素在元素周期表中的信息,铜元素的原子序数为___;
(2)铜离子(Cu2+)的核外电子数为____________;
(3)电气工业上常用铜作电缆的内芯,是利用铜具有良好的_____性;
(4)铜是一种不活泼的金属,但铜制品长期露置在潮湿空气中,表面变绿色,即生成了“铜绿”(化学式:Cu2(OH)2CO3)。
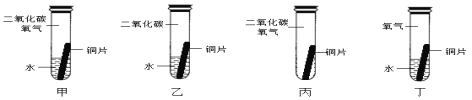
某同学根据铜绿的成分Cu2(OH)2CO3作出猜想:金属铜锈蚀的条件除有氧气和水外,还必须有二氧化碳。为证明“必须有二氧化碳”,需要进行如图所示实验中的_____(选填实验编号甲、乙、丙、丁)
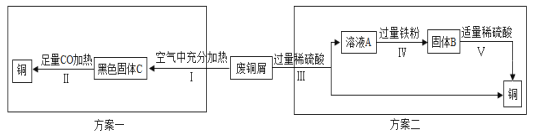
(5)某兴趣小组以锈蚀严重的废铜屑为原料(假设不含其他杂质)制取纯铜。如图是兴趣小组设计的两种回收铜的实验方案:
查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
(分析评价)
①步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是___________;
②步骤Ⅳ过程发生反应的化学方程式为__________________、_________________;
③同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一_____(填“>”或“=”或“<”)方案二。以上两种方案中,方案二优越于方案一,理由是________(答一点)。
(拓展探究)在方案一中,小明和小丽分别取24克氧化铜,用CO还原,小明得到19.2克红色固体,小丽得到20.8克红色固体。为什么两人得到的红色固体质量不相等?
查阅资料:
Ⅰ.CO还原CuO时也可产生红色的氧化亚铜(Cu2O)
Ⅱ.Cu2O+H2SO4(稀)=Cu+CuSO4+H2O
他们分析推断:
④一致认为________(填“小明”或“小丽”)的产物中肯定含有Cu2O;
⑤用CO还原4克CuO得到红色固体a克,若红色固体为Cu和Cu2O的混合物,则a的取值范围为____________;
⑥可以用简单的实验验证红色固体中是否有Cu2O,请简述操作、现象及结论:_____。
(6)我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。为了测定某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),现将30g稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定本次生成氢气的质量,实验数据见表。试求:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的质量(g) | 10 | 10 | 10 |
本次生成氢气的质量(g) | 0.04 | m | 0.02 |
①m=____________。
②此黄铜样品中铜的质量分数是多少_______?。
③稀盐酸的溶质质量分数是_______。
④在坐标系中画出生成氢气总质量与加入盐酸质量关系的图像。______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学来源于生活,又服务于生活,请用所学化学知识回答下列问题。
(1)日常生活中,切菜刀采用的防锈措施是_________________。
(2)古人在野外生火时常“钻木取火”。“钻木取火”满足的燃烧的条件是____(填序号)。
A.提供可燃物 B.与氧气接触 C.达到燃烧所需的最低温度
(3)下图金属应用的实例,主要利用金属的导热性的是_______(填序号);

A电缆 B.电热壶 C.金属丝 D.金属乐器
(4)氢氟酸(HF)能刻画玻璃,其中有一个化学反应的化学方程式是:CaSiO3+6HF=X+SiF4↑+3H2O,则X的化学式为_______________;
(5)钛合金与人体具有很好的“相容性”,可以用来制造人造骨。由此得知钛合金具有的优良性能是_____________。(答一点即可)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组对一包干燥的红色粉末组成进行探究。请你参与并回答问题。
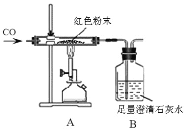
(教师提醒)它由Cu 、Fe2O3两种固体中的一种或两种组成。
(提出猜想)红色粉末可能的组成,
猜想①:红色粉末是Cu; 猜想②:红色粉末是Fe2O3;
猜想③:红色粉末是Cu 和Fe2O3的混合物
(实验探究)同学们为确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右下图在通风橱中进行实验。
反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应后 |
玻璃管和红色粉末的总质量为37.3 g | 玻璃管和固体物质的总质量为36.1 g |
(1)A装置中发生反应的化学方程式_______,玻璃管中应该观察到的现象是_________
(2)小蒋同学初步分析表中的数据后,马上得出猜想_______(填“①”“②”“③”)肯定不正确,理由是_______________。
(3)有同学认为为了防止烧杯中液体倒吸,本实验停止加热前应先断开A和B的连接,但小明认为不需要,理由是_________________
(反思评价)(4)实验后小组内有同学指出:上图装置未进行尾气的处理。于是有同学设计了用如图装置代替原装置,则C装置的作用有___________________(至少答两点)。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组利用手持技术(利用传感器和数据采集器实时测量技术)测量模拟建筑火灾现场中氧气含量、二氧化碳浓度和温度的变化,验证建筑火灾逃生策略的合理性。
如图1所示,在圆筒形透明塑料实验容器中底部3个点(K1、K2、K3)分别放置甲、乙、丙3根高低不同的蜡烛;如图2所示,在3根烛芯一定距离都依次放置氧气传感器(a1、a2、a3)、温度传感器(b1、b2、b3)和二氧化碳传感器(c1、c2、c3)。点燃蜡烛后,盖上实验容器顶盖后,采集3根蜡烛火焰附近相关数据。
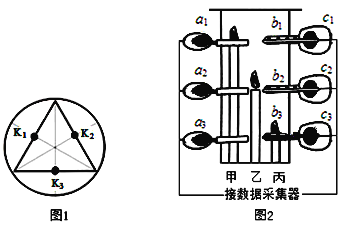
表1 3根蜡烛熄灭的时间 | 表2 熄灭时不同高度所测的含氧量﹪ | |||||||
蜡烛 | 甲 | 乙 | 丙 | 熄灭时间/s | 低处(a3) | 中处 (a2) | 高处(a1) | |
熄灭时间/s | 106 | 164 | 199 | 106 | 19.8 | 19.1 | 18.5 | |
164 | 18.9 | 17.7 | x | |||||
199/span> | 18.6 | 17.1 | 16.5 |
(1)实验获取3根蜡烛熄灭的时间如表1所示,并提取每根蜡烛在这三个时间时火焰附近的含氧量如表2所示。
① 三支蜡烛熄灭的先后顺序是______。
② 表2中,x可能是______(填序号)。
A.17.9 B.17.2 C.16.1
③ 蜡烛熄灭时,含氧量均不为零。请据此对燃烧条件的表述做进一步的细化:______。
④ 纵看表2数据,______(填“低”“中”或“高”) 处氧气含量下降最慢。
(2)实验获取温度和二氧化碳浓度随时间变化曲线依次如图3和图4所示。
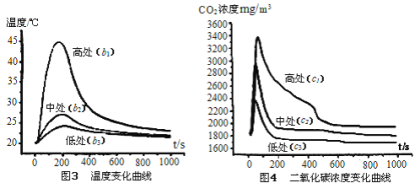
由此可知,点燃蜡烛后二氧化碳浓度由低处到高处逐渐变______,原因是______。
(3)从以上分析,建筑火灾时,人员应低下身子沿墙壁或贴近地面逃生,依据是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】木炭还原氧化铜和一氧化碳还原氧化铜的实验装置如图所示,下列说法正确的是( )
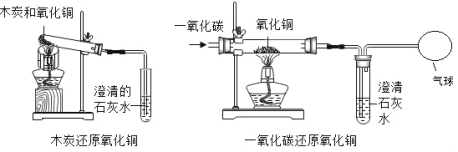
A. 两个反应都属于置换反应
B. 两个反应的条件均为“加热”
C. 两个反应中,碳元素的化合价都升高
D. 两个实验中,试管或玻璃管内固体质量的减少量都等于产生的二氧化碳的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铜矿(主要成分CuFeS2)经初步处理后,所得溶液甲中的溶质为硫酸铁和硫酸铜(溶质之间不发生反应)。某同学通过废铁屑与溶液甲反应,制取补血剂原料绿矾(FeSO4·7H2O)并得到副产品铜。主要步骤如图所示:
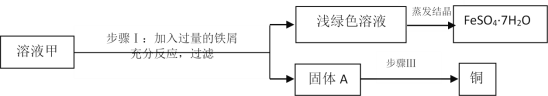
(1)已知步骤I中,铁与硫酸铁发生化合反应,请写出该反应的化学方程式_________。
(2)步骤Ⅰ中,生成铜的化学方程式_________。
(3)步骤Ⅰ中,加入的铁屑应过量的目的是_________。
(4)步骤Ⅲ得纯铜的方法是:加过量X、过滤、洗涤、干燥,其中X是_______(填名称)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学小组同学做镁条在空气中燃烧实验时,发现生成物中还有少量黑色固体,针对这一现象及相关问题,他们开展了如下探究,请仔细阅读并参与他们的探究之旅。
(探究目的)探究黑色固体是镁与空气中什么物质反应产生的?
(查阅资料)1.稀有气体一般与其他物质反应 2.光亮的镁条与水反应,表面会生成白色固体。
(分析猜想)分析空气中各种成分,进行猜想:
(1)猜想①是氧气 猜想②是氮气 猜想③是__________________
(实验一)镁带与氧气的反应
(一)甲同学探究了影响过氧化氢制取氧气速度的某种因素,进行了三次实验并记录各收集相同体积氧气所需要的时间如下表
实验 | 过氧化氢的浓度 | 过氧化氢溶液质量/g | 二氧化锰质量/g | 收集时间/s |
1 | 10% | 20 | 40 | |
2 | 15% | 20 | 1 | 20 |
3 | 20% | X | 1 | 12 |
(2)第 3 次实验中,X 的值应为_____
(3)实验结论:在相同条件下,___________________过氧化氢分解得越快。
(二)乙同学在量筒中盛满水,倒置于水槽中,通过分液漏斗把 20mL 某浓度的过氧化氢溶液加入锥形瓶中,记录量筒中气体的体积(如图 )。数据如下表:
时间/min | 1 | 3 | 5 | 7 | 9 | 10 |
量筒读数/mL | 60.0 | 82.0 | 88 | 89.5 | 90 | 90 |
(4)请根据以上过程和实验数据综合分析,最终生成氧气的体积是_____mL
(5)请在下面坐标图中绘制出 0~10 min 生成氧气体积随时间变化的曲线_____________。
(三)燃烧镁带,观察现象
将镁带打磨光亮,点燃伸入盛满氧气的集气瓶中,产生大量白烟,生成白色固体。实验结论:镁与氧气反应生成白色的氧化镁
(实验二)镁带与氮气反应
(一)收集氮气
(二)燃烧镁带,观察现象
将镁带打磨光亮,点燃伸入盛满氮气的集气瓶中,瓶内壁附着一层淡黄色的固体。
(6)实验结论:镁与氮气在点燃条件下发生化合反应生成淡黄色的氮化镁(Mg3N2) 该反应的化学方程式是________
(探究结论 1)(7)综上分析,关于镁在空气中燃烧产生黑色固体的猜想是猜想__________(填序号)成立。
(探究结论 2)(8)如果用足量的镁代替红磷进行空气组成实验,实验测得氧气的体积分数比实际值______(填“偏大”或“偏小”)
(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气含量(如图),由于红磷需要在瓶外点燃再伸入瓶内,常常带来污染以及误差。
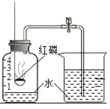
(实验改进)同学们选择了着火点更低的白磷,并对装置图做了改进(如图)。主要操作是:在实际容积为 180mL 的集气瓶里,先装进 50mL 的水,再按图连好仪器,按下热的玻璃棒,白磷立即被点燃。
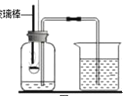
(9)白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是______________
(10)若实验中无误差,最终集气瓶中水的体积为__________________mL
(11)集气瓶里预先装置的 50mL 水的作用,其一是为了加快集气瓶的冷却速度,其二则主要是_____________
(实验与交流)
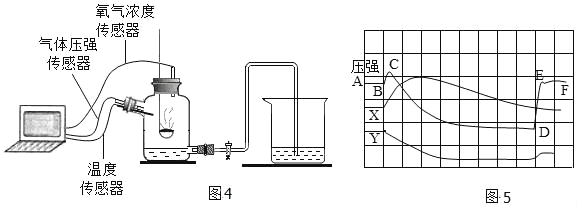
(12)为了帮助同学们更好地理解空气中氧气含量的实验原理,老师利用传感器技术定时测定了实验装置(图 4)内的压强、温度和氧气浓度,三条曲线变化趋势如图 5 所示。Y 曲线表示的是_______________(填“温度”或“氧气浓度”或“压强”)变化趋势;X 曲线中 CD 段上升的原因是___________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】乙酸(俗称醋酸)是我们生活中常见的一种饱和脂肪酸,下表列举了部分饱和脂肪酸的化学式、熔点和沸点,请你根据表中信息回答下列问题:
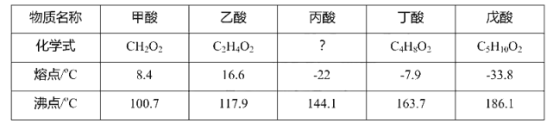
(1)试推测丙酸的化学式为__________;
(2)饱和脂肪酸的命名与分子中的______原子个数有关;
(3)这五种饱和脂肪酸中氢元素的质量分数最大的是________(填物质名称);
(4)乙酸的水溶液中会含有较多的氢离子,则![]() 个氢离子可以表示为_______(填化学符号);
个氢离子可以表示为_______(填化学符号);
(5)甲酸与浓硫酸共热,常用于实验室制取一氧化碳,其化学方程式可以表示为: HCOOH![]() H2O+CO该反应所属的基本反应类型是___________.
H2O+CO该反应所属的基本反应类型是___________.
(6)下列有关戊酸的说法正确的是_______(填序号)
A.戊酸是由原子构成的 B.戊酸中含有氧分子
C.戊酸属于氧化物 D.戊酸分子中碳、氢、氧原子的个数比为5:10:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com