
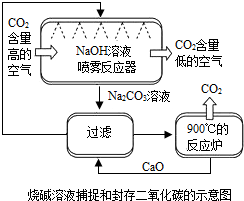
 为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法.
为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法.分析 根据题目给出的信息可知:在整个流程中,循环利用的物质是生石灰;烧碱溶液捕捉和封存二氧化碳法,即二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,NaOH溶液喷成雾状的目的是增大气体与液体的接触面积,使反应更充分;因为生石灰和水反应生成熟石灰,熟石灰和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,因此过滤出的是碳酸钙白色沉淀;在整个流程中,循环利用的物质是生石灰和氢氧化钠溶液.
解答 解:①烧碱溶液捕捉和封存二氧化碳法,即二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,化学方程式为:CO2+2NaOH═Na2CO3+H2O,NaOH溶液喷成雾状的目的是增大气体与液体的接触面积,使反应更充分;
②因为生石灰和水反应生成熟石灰,熟石灰和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,因此过滤出的是碳酸钙白色沉淀,化学方程式为:CaCO3;CaO+H2O═Ca(OH)2;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
③在整个流程中,循环利用的物质是生石灰和氢氧化钠溶液,化学式为:CaO、NaOH.
故答案为:①2NaOH+CO2=Na2CO3+H2O,增大反应物间接触面积,使反应更充分;
②CaCO3,CaO+H2O=Ca(OH)2,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
③CaO、NaOH.
点评 本题考査了有关二氧化碳造成的温室效应问题、酸碱盐的性质和化学方程式的书写等,考查的知识点比较多,要综合应用.环境问题不仅引起了全球的重视而且也是近几年中考的热点问题.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:初中化学 来源: 题型:解答题
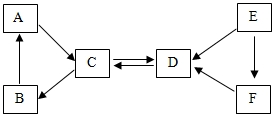 现有A~F六种常见物质,其中B是食品包装中的常用的干燥剂,A、B、C三种白色固体都含有同种金属元素,E是固体单质,D、E、F都含有同种非金属元素,它们的转化关系如图.请回答:
现有A~F六种常见物质,其中B是食品包装中的常用的干燥剂,A、B、C三种白色固体都含有同种金属元素,E是固体单质,D、E、F都含有同种非金属元素,它们的转化关系如图.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe2O3 | B. | CO | C. | Fe | D. | CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 木炭燃烧后生成黑色固体 | |
| B. | 铁丝伸入盛有氧气的集气瓶中剧烈燃烧 | |
| C. | 红磷在空气中不能燃烧 | |
| D. | 硫燃烧后生成有刺激性气味的气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/(g) | 31 | 34 | 37 | 40.6 | 42 | 45.5 | 48 | 51 | 54 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com