

分析 氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠;
根据实验现象可以判断物质的组成,根据物质的性质可以判断实验现象;
碳完全燃烧生成二氧化碳,不完全燃烧生成一氧化碳;
根据物质中氢元素的质量分数及其提供的数据可以判断物质的组成.
解答 解:【实验讨论】
得到的蓝色沉淀一定是氢氧化铜,氢氧化钠和硫酸铜反应的化学方程式为:2NaOH+CuSO4═Na2SO4+Cu(OH)2↓.
故填:2NaOH+CuSO4═Na2SO4+Cu(OH)2↓.
【实验设计】
B中无水CuSO4变蓝色,证明有有水生成;由于SO2气体能使酸性高锰酸钾稀溶液褪色,所以C中酸性高锰酸钾溶液褪色,证明生成SO2.
故填:水;酸性高锰酸钾溶液褪色.
【实验反思】
(1)5mL氢氧化钠溶液的体积远远大于乙2滴氢氧化钠溶液的体积,因此NaOH溶液不足时就能生成浅绿色沉淀,此实验利用的科学方法是控制变量法.
故填:不足.
(2)因为碱式硫酸铜可表示为aCu(OH)2•bCuSO4,则Cu4(OH)6SO4还可表示为:3Cu(OH)2•CuSO4.
故填:3Cu(OH)2•CuSO4.
【拓展延伸】
(1)当反应物的量不同,产物可能不同,例如碳燃烧时,氧气足量时生成二氧化碳,氧气不足时生成一氧化碳.
故填:碳燃烧时,氧气足量时生成二氧化碳,氧气不足时生成一氧化碳.
(2)根据常温下二氧化碳和水反应生成碳酸;在光照作用下,二氧化碳和水在植物的叶子中发生光合作用生成氧气,可知当反应物相同,而反应条件不同时,产物也可能不同.
故填:反应条件;
(3)0.9g水中氢元素的质量为:0.9g×$\frac{2}{18}$×100%=0.1g,
则碱式硫酸铜中氢元素的质量分数为:$\frac{0.1g}{8.9g}$×100%=1.12%,
Cu2(OH)2SO4中氢元素的质量分数为:$\frac{2}{258}$×100%=0.78%,
Cu3(OH)4SO4中氢元素的质量分数为:$\frac{4}{356}$×100%=1.12%,
Cu4(OH)6SO4中氢元素的质量分数为:$\frac{6}{454}$×100%=1.32%,
根据计算的结果可知,所得浅绿色沉淀的化学式为Cu3(OH)4SO4.
故填:Cu3(OH)4SO4.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:解答题
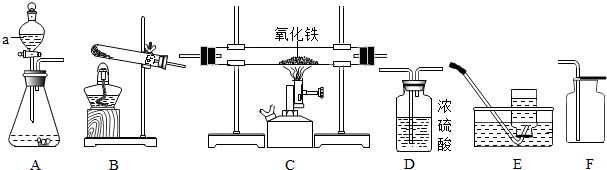
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | FeCl2(CuCl2) 铁粉 | B. | CO2(CO) 石灰水 | ||
| C. | NaCl(Na2CO3) 稀盐酸 | D. | Cu(CuO) 一氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
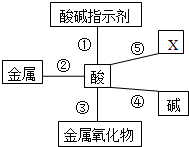 构建知识网络能帮助我们理解知识间的内在联系.请分析如图酸的化学性质知识网络,完成下列问题:
构建知识网络能帮助我们理解知识间的内在联系.请分析如图酸的化学性质知识网络,完成下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 钠原子的结构示意图中,x=10 | |
| B. | 在元素周期表中,钠元素的原子序数为11 | |
| C. | 在化学反应中,氯原子容易失去电子 | |
| D. | 氯化钠是由氯化钠离子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
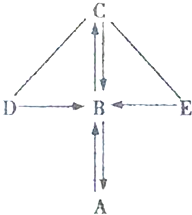 如图所示,A、B、C、D、E是初中化学常见的五种不同类别的物质,含有氧元素.其中A为单质,D在工业中可以用于除锈;图中“一”表示相连的物质可以发生反应,“→”表示-种物质能生成另一种物质(部分反应物、生成物及反应条件省略).
如图所示,A、B、C、D、E是初中化学常见的五种不同类别的物质,含有氧元素.其中A为单质,D在工业中可以用于除锈;图中“一”表示相连的物质可以发生反应,“→”表示-种物质能生成另一种物质(部分反应物、生成物及反应条件省略).查看答案和解析>>
科目:初中化学 来源: 题型:填空题
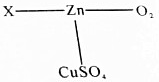 请用所学化学知识解释下列原理.
请用所学化学知识解释下列原理.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com