
A、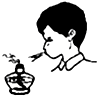 熄灭酒精灯 |
B、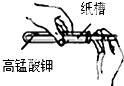 添加药品 |
C、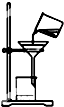 过滤 |
D、 量取35ml液体 |


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
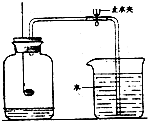 (1)用如图所示装置测定空气里氧气含量时,红磷熄灭后,打开止水夹后,发现最终盛入集气瓶的水的体积小于
(1)用如图所示装置测定空气里氧气含量时,红磷熄灭后,打开止水夹后,发现最终盛入集气瓶的水的体积小于| 1 |
| 5 |
查看答案和解析>>
科目:初中化学 来源: 题型:
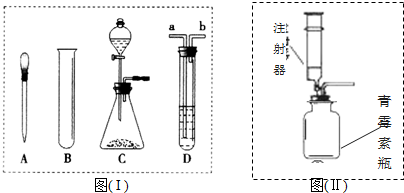
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
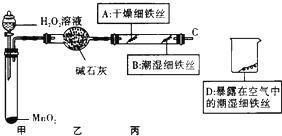 全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.下面是对铁的腐蚀条件及铁锈组成的探究.
全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.下面是对铁的腐蚀条件及铁锈组成的探究.
| ||
| ||
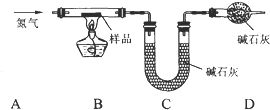
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com