
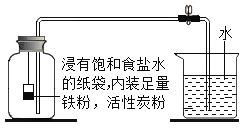
【题目】小芳同学通过查阅资料,设计如图所示装置,测定空气中氧气含量。已知广口瓶有效容积为146mL,实验45分钟后打开止水夹,水从烧杯流入广口瓶中的体积为29mL。则空气中氧气的体积分数约为_____(精确到0.1%);该实验能否有效解决拉瓦锡实验中的汞污染问题_____(填“能”或“否”);该实验设计依据的原理是_____。(装置中的饱和食盐水、活性炭会加速铁生锈)
科目:初中化学 来源: 题型:
【题目】粗盐中常含有CaCl2、MgCl2和可溶性的硫酸盐等。除杂操作中为了保证反应完全,所加试剂都应适当过量。如图是粗盐提纯的简单流程。

X、Y、Z、W代表所加溶液,X、Y、Z、W分别是( )
A.BaCl2 Na2CO3 NaOH HCl
B.Na2CO3 BaCl2 HCl NaOH
C.Na2CO3 BaCl2 NaOH HCl
D.NaOH Na2CO3 HCl BaCl2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】侯德榜制碱法的原理是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱.此过程可以表示为:①![]() (此反应是放热反应) ②煅烧碳酸氢钠后,得到纯碱。侯氏制碱法生产流程示意图:
(此反应是放热反应) ②煅烧碳酸氢钠后,得到纯碱。侯氏制碱法生产流程示意图:

[查阅资料]I.氨化的饱和食盐水;即是指向饱和食盐水中通入氨气;Ⅱ.NaHCO3低温时溶解度很小; III在通常状况下,NH3极易溶于水,CO2能溶于水。
(1)请你填写出括号中物质的化学式_____________。
(2)用化学方程式表达煅烧炉中发生的反应___________。
(3)向饱和的食盐水中,先通入氨气再通人二氧化碳的目的是____________。
(4)向母液中通入氨气的原因是___________;把母液冷却至10°C以下的目的是________。
(5)侯氏制碱法的生产流程中,可以循环利用的物质是____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
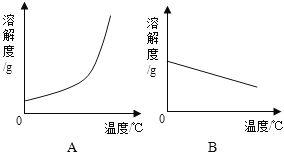
【题目】下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/(g/100g水) | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
①依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中表示NaOH溶解度曲线的是_____(填A或B)。
②把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有_____。(填一种)
③20℃时,191g饱和NaOH溶液,恒温蒸发10g水后,可析出NaOH晶体_____g。
④现有60°C时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是_____。
⑤20℃时,欲测定NaOH溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH_____(填“偏大”、“偏小”或“不受影响”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
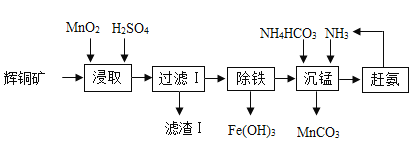
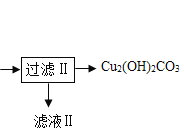
(1)请写出碱式碳酸铜的化学式_____
(2)滤渣l中有什么_____
(3)过滤用到到仪器有那些_____
(4)除铁的化学方程式是什么_____
(5)图中能重复利用的物质有那些_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列叙述正确的是( )
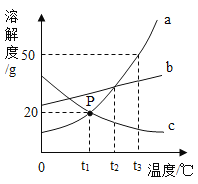
A. t1℃时,a、c两种物质饱和溶液的溶质质量分数为20%
B. 将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法
C. 将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a=c
D. 将150g a物质的饱和溶液从t3℃降温至t1℃,可析出30g a物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
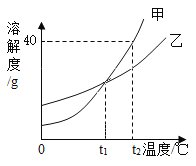
A.t1℃时,甲、乙的饱和溶液中溶质的质量相等
B.t2℃时,甲的饱和溶液中溶质和溶液的质量比为2:5
C.t2℃时,将等质量的甲乙配制成该温度下的饱和溶液,所得溶液的质量甲>乙
D.分别将甲、乙的饱和溶液从t2℃降温到t1℃,所得溶液中溶质质量分数相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定量的铁粉与铜粉的混合物中逐滴加入稀硫酸至过量,下图是反应过程中某种物质的质量Y 随加入稀硫酸的质量X 变化的关系,则Y 可能表示( )
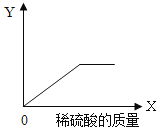
A.铜粉的质量B.生成硫酸铜的质量
C.溶液的总质量D.生成硫酸亚铁的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知:碱式碳酸镁分解反应方程式为:![]() 探究小组利用下图测定xMgCO3·yMg(OH)2·zH2O组成。
探究小组利用下图测定xMgCO3·yMg(OH)2·zH2O组成。

实验步骤:
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞a,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热。
步骤4:打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量。
步骤5:称量相关装置的质量。
(1)步骤④中缓缓通入空气数分钟的目的是____________。
(2)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的__________(填字母)连接在____________(填装置连接位置)。装置丁的作用是____________
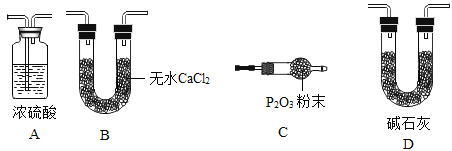
(3)若按正确装置进行实验,测得如下数据:
A 反应前玻璃管的质量100.0g
B 反应后玻璃管与残留固体总质量120.0g
C 装置乙实验后增重9.0g
D 装置丙实验后增重17.6g
根据实验测定的数据,求出碱式碳酸铜(xMgCO3·yMg(OH)2·zH2O)中x:y:z=____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com