
| 盐溶液 | NaCI | Na2CO3 | BaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述氢氧化钠固体样品10.0g溶于50ml水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应后,静置. | ________ | 说明久置固体中,一定含有Na2CO3 |
| ②用玻璃棒蘸取少量①中充分反应后的上层清液滴在一小块pH试纸上,与标准比色卡对比,测出pH | pH=11 | 说明久置固体中,还一定含有________ |
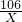 =
=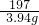
 ×100%=78.8%
×100%=78.8%

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
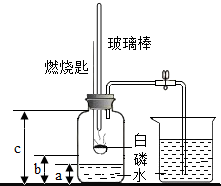 某化学研究性学习小组在学习了“空气中氧气含量测定”实验的基础上,改进了教材中的实验,设计出如图所示的实验装置.
某化学研究性学习小组在学习了“空气中氧气含量测定”实验的基础上,改进了教材中的实验,设计出如图所示的实验装置.查看答案和解析>>
科目:初中化学 来源: 题型:
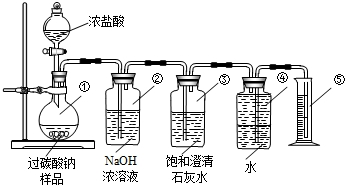
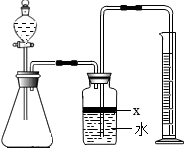 氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,某化学研究性学习小组设计并完成了如下实验.
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,某化学研究性学习小组设计并完成了如下实验.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com