
| 序号 | 溶液中的盐 | 固体不溶物的成分 |
| ① | FeCl2、CuCl2、FeCl3 | ______ |
| ② | ______ | 无 |
| ③ | FeCl2、CuCl2 | ______ |
| ④ | ______ | Cu |
| ⑤ | ______ | Fe、Cu |
| 组别 | ① | ② | ③ | ④ |
| 混合粉末质量/g | 40 | 40 | 40 | 40 |
| FeCl3溶液体积/mL | 150 | 300 | 330 | 350 |
| 反应后剩余固体质量/g | 23.2 | 6.4 | 2.56 | x |
| 序号 | 溶液中的盐 | 固体不溶物的成分 |
| ① | 无 | |
| ② | FeCl2、CuCl2 | |
| ③ | Cu | |
| ④ | FeCl2 | |
| ⑤ | FeCl2 |
| 330 |
| 300 |
|
|
| 20mL |
| 30mL |


科目:初中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:多选题
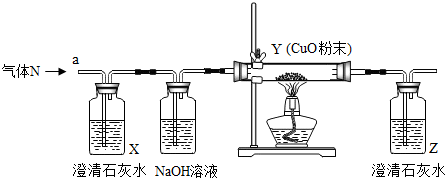
| 可能出现的实验现象 | 气体N的组成 | |||
| X中液体 | Y中黑色粉末 | Z中液体 | ||
| A | 不浑浊 | 变成光亮的红色 | 不浑浊 | H2 |
| B | 不浑浊 | 变成光亮的红色 | 变浑浊 | CO和CO2 |
| C | 变浑浊 | 变成光亮的红色 | 不浑浊 | H2和CO2 |
| D | 变浑浊 | 变成光亮的红色 | 变浑浊 | H2和CO |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
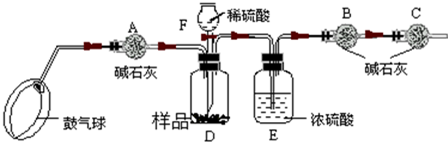
| (20手0?新区二模)某化学兴趣小组有一次活动4内容是:对一包干燥4红色粉末组成进行探究.请你参与并回答有关问题. 教师提醒:它由Cu、Fe293、Fe(9H)3三种固体中4一种或两种组成. 提出猜想:红色粉末可能4组成有: ①只有Cu&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p; ②只有Fe293 ③只有Fe(9H)3 ④是Fe293、Fe(9H)34混合物 ⑤是Cu、Fe2934混合物&nb6p;&nb6p;&nb6p; ⑥是Cu、Fe(9H)34混合物 资料获悉:(手)2Fe(9H)3
(2)白色无水Cu694遇水变蓝 (3)Cu在FeCl3溶液中发生反应:2FeCl3+Cu═2FeCl2+CuCl2 探究思路:利用物质4性质设计实验加以甄别,先分别探究其中是否含有Fe(9H)3、Cu等,逐步缩小范围,然后再选择适当4 试剂和方法,通过实验来探究其组成.(装置内空气中4水蒸气、C92忽略不计) 实验探究: (手)甲同学取适量红色粉末装入试管中,按图手进行实验.结果无水Cu694没有变蓝,从而排除猜想中4&nb6p;(填猜想中4序号). (2)在甲同学实验结论4基础上,乙同学另取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解,溶液变色.乙同学认为可以排除猜想中4①和⑤,而丙同学认为只能排除猜想①,你认为&nb6p;4观点正确(填“乙”或“丙”).  (3)丁同学为进一步确定红色粉末4组成,称取该粉末5.0g装入硬质玻璃管中,按图2在通风橱中进行实验.开始时缓缓通入C9气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通C9气体直至玻璃管冷却.反应前后称量相关装置和物质4总质量,其数据如y表:
(手)装置A中先通C9气体4作用是&nb6p;. (2)应该选择&nb6p;组4实验数据计算来确定红色粉末4组成.最终计算结果表明:该红色粉末4组成是猜想中4第&nb6p;组(填序号). (3)写出A装置中发生反应4化学方程式&nb6p;;实验中观察到A装置中4现象为&nb6p;. (4)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B4连接处?&nb6p;(填“需要”或“不需要”),理由是&nb6p;. 反思评价:戊同学指出:从环保角度,图36-2装置有严重不足之处.你认为应该如何改进?&nb6p;. 拓展延伸:有同学提出丁同学上述实验中4C9还可以用H2代替,并将图36-2中B装置换成盛有碱石灰(生石灰和氢氧化钠固体混合物)4干燥管,来确定该红色粉末4组成,你认为是否可行?&nb6p;(填“可行”或“不可行”). |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com