
 Ti+2MgCl2,由生成钛的质量24g计算消耗金属镁的质量.
Ti+2MgCl2,由生成钛的质量24g计算消耗金属镁的质量. ×100%,反应后溶液的质量可根据质量守恒定律,由反应前混合物的质量总和减去生成的沉淀碳酸钙而求得,如此一来,只需要用碳酸钠的质量表示出生成的氢氧化钠的质量和形成沉淀的质量,即可利用反应后溶液中的溶质的质量分数建立等而计算出碳酸钠的质量,再使用溶质的质量分数计算公式计算出原碳酸钠溶液的溶质质量分数.
×100%,反应后溶液的质量可根据质量守恒定律,由反应前混合物的质量总和减去生成的沉淀碳酸钙而求得,如此一来,只需要用碳酸钠的质量表示出生成的氢氧化钠的质量和形成沉淀的质量,即可利用反应后溶液中的溶质的质量分数建立等而计算出碳酸钠的质量,再使用溶质的质量分数计算公式计算出原碳酸钠溶液的溶质质量分数. Ti+2MgCl2,
Ti+2MgCl2,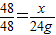
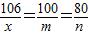
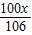
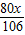
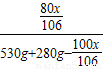 ×100%=1%
×100%=1% 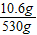 ×100%=2%
×100%=2%

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 35、人们的日常生活离不开金属和金属材料,高科技、新材料的开发和应用也需要它.下面是小明同学对该部分知识的学习与探究.
35、人们的日常生活离不开金属和金属材料,高科技、新材料的开发和应用也需要它.下面是小明同学对该部分知识的学习与探究.| 实验步骤 | 观察到的现象 | 实验结论 |
取样,将铁与铜分别放入稀盐酸中 |
铁的表面有气泡,铜的表面无气泡 |
铁的活动性大于铜 |


查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
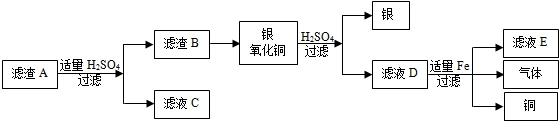
查看答案和解析>>
科目:初中化学 来源: 题型:
 金属盒金属化合物是重要的资源,生活、工业、农业生产都离不开金属盒金属化合物.
金属盒金属化合物是重要的资源,生活、工业、农业生产都离不开金属盒金属化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com