
分析 根据催化剂的概念可知,催化剂能改变化学反应的速率,而本身的质量和化学性质在反应前后不改变进行分析.
解答 解:【实验验证】实验二:在实验一的试管中加人W gFe2O3粉末,有大气泡产生,然后伸入带火星的木条,木条复燃.说明溶液中加入氧化铁粉末,分解速率加快;
实验三:待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体的质量仍为W g.说明反应前后物质的质量不变;
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验,探究氧化铁粉末的化学性质是否改变.
故答案为:【实验验证】溶液中加入氧化铁粉末,分解速率加快;
实验三:反应前后物质的质量不变;
【反思评价】氧化铁粉末的化学性质是否改变.
点评 本题主要考查了收集气体的方法、催化剂的催化作用及其正确设计实验方案等方面的内容,可以依据题干提供的信息结合已有的知识进行.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
 如图,冰袋是一种冰块的升级替代产品,广泛用于医疗高烧降温退热,体育界运动员训练及比赛过程中意外碰伤、扭伤、摔伤等使用.某校兴趣小组打算开发一种冷袋,内装一种化合物和50mL水.“研究比较3种化合物,哪种化合物的降温效果最好?”
如图,冰袋是一种冰块的升级替代产品,广泛用于医疗高烧降温退热,体育界运动员训练及比赛过程中意外碰伤、扭伤、摔伤等使用.某校兴趣小组打算开发一种冷袋,内装一种化合物和50mL水.“研究比较3种化合物,哪种化合物的降温效果最好?”| 杯子 | 化合物 | 始温(℃) | 终温(℃) |
| A | NH4Cl | 25 | 18 |
| B | CaCl2 | 23 | 28 |
| C | NaCl | 22 | 20 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 0个 | B. | 1个 | C. | 2个 | D. | 3个 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 原子种类 | 质子数 | 中子数 | 核外电子数 |
| 氢 | 1 | 0 | 1 |
| 碳 | 6 | 6 | 6 |
| 氧 | 8 | 8 | 8 |
| 钠 | 11 | 12 | 11 |
| 氦 | 17 | 18 | 17 |
| 铁 | 26 | 30 | 26 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
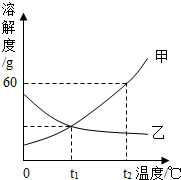 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
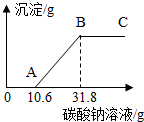 在做完“用稀盐酸和石灰石反应制取二氧化碳”的实验后,小明突然想到:是否可以测得实验所用的石灰石中碳酸钙的含量呢?小明又进行了如下实验:①将试管中反应的剩余物过滤并多次用蒸馏水洗涤,得到滤液和滤渣.②向滤渣中滴加稀盐酸,无明显的现象.③将滤渣干燥后称量,质量为0.5g.④向滤液中加入10%的Na2CO3溶液,获得了相关的数据,并绘制成如图所示的图象.根据小明的实验过程回答下列问题.(假设石灰石中的其余杂质不与稀盐酸反应)
在做完“用稀盐酸和石灰石反应制取二氧化碳”的实验后,小明突然想到:是否可以测得实验所用的石灰石中碳酸钙的含量呢?小明又进行了如下实验:①将试管中反应的剩余物过滤并多次用蒸馏水洗涤,得到滤液和滤渣.②向滤渣中滴加稀盐酸,无明显的现象.③将滤渣干燥后称量,质量为0.5g.④向滤液中加入10%的Na2CO3溶液,获得了相关的数据,并绘制成如图所示的图象.根据小明的实验过程回答下列问题.(假设石灰石中的其余杂质不与稀盐酸反应)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com