生铁和钢都是合金,钢中碳的含量在0.03%~2.0%之间,生铁中碳的含量在2.0%~4.3%之间.将一块质量为9.00g的铁合金放入锥形瓶中,再向锥形瓶中加入100g稀硫酸,恰好使铁合金中的铁完全反应(碳不溶于稀硫酸;铁合金中其它元素含量很低,可忽略不计),测得生成氢气的体积为3.50L(氢气在该条件下的密度为0.0880g/L).试计算回答:(计算结果保留三位有效数字)
(1)生成氢气的质量.
(2)该铁合金中含铁的质量.
(3)该铁合金是生铁还是钢?
解:(1)生成氢气的质量为:3.50L×0.0880g∕L=0.308g
(2)设含铁的质量为x
Fe+H
2SO
4═FeSO
4+H
2↑
56 2
x 0.308g
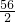
=
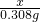
,
x=8.624g
(3)该铁合金中碳元素的质量分数为

×100%≈4.2%
∵2.0%<4.2%<4.3%
∴该铁合金是生铁.
答:(1)生成氢气的质量为0.308g.
(2)铁合金中含铁的质量为8.624g.
(3)该铁合金是生铁.
分析:(1)由生成氢气的体积和氢气的密度可以计算出生成氢气的质量.
(2)由生成氢气的质量,根据铁与稀硫酸反应的化学方程式可以计算出发生反应的铁的质量.
(3)由铁合金的质量和所含铁的质量,可以计算出铁合金中的含碳量,对照生铁和钢的含碳量,就可以确定该铁合金是生铁还是钢.
点评:本题主要考查质量与体积之间的换算、有关化学方程式的计算和质量分数的计算.
体积与质量之间的换算可以根据m=ρv这一公式进行.
由生成物的质量可以根据化学方程式计算出反应物的质量.
某元素或物质的质量分数该元素或物质的质量与总质量的百分比.

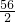 =
=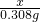 ,
, ×100%≈4.2%
×100%≈4.2%

 阅读快车系列答案
阅读快车系列答案