
| A. | 石灰石 | B. | 纯碱 | C. | 熟石灰 | D. | 苛性钠 |
科目:初中化学 来源: 题型:解答题
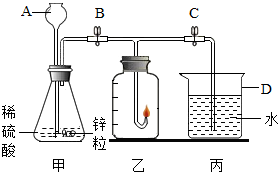 某化学兴趣小组的同学准备用氢气燃烧法测定空气中氧气的体积分数,设计的实验装置如图:
某化学兴趣小组的同学准备用氢气燃烧法测定空气中氧气的体积分数,设计的实验装置如图:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ① | 1.2g | / | |
| ② | 1.2g | CuO 0.5g | |
| ③ | 1.2g | MnO2 0.5g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验步骤和现象 | 结论 |
| 取无色溶液少许于试管中,向其中加入过量的氯化钙溶液,有白色沉淀产生,过滤,再向滤液中加入无色酚酞试液,溶液变红 | 猜想Ⅲ成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
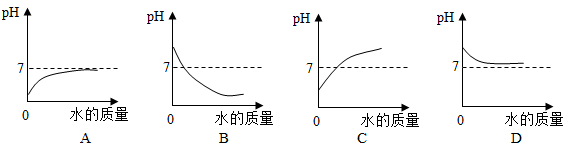
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 原固体混合物质量 | 10g | 10g | 10g | 10g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 2g | m | 5g | 5g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 呼吸作用 | B. | 代谢作用 | C. | 吸收作用 | D. | 光合作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com