
【题目】某兴趣小组在蒸发浓缩FeCl3溶液时发现有刺激性气味的气体生成,同时溶液中出现红褐色固体。小组同学对刺激性气味气体做出猜想:
(猜想)①Cl2 ②HCl ③_____。
(资料)①Cl2溶于水,形成的溶液显酸性,具有较强的漂白能力,能使石蕊溶液褪色。
②红褐色固体碱式氯化铁晶体的化学式为Fe2(OH)aClbxH2O,它在50℃时开始失去部分结晶水,在200℃完全分解为Fe2O3、H2O、HCl气体。
③浓H2SO4不吸收HCl气体。
(1)小组同学将生成的气体通入紫色石蕊溶液中看到_____现象,证明猜想②成立。
(2)为确定固体的组成,进行如下实验:
(实验)称取50.4g固体按下图进行实验。充分持续加热至200℃,最终得到Fe2O316.0g,B、C装置最终分别增重19.8g、14.6g。
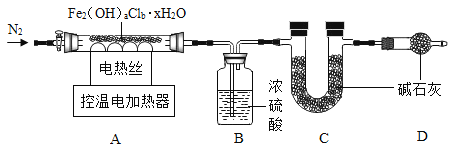
①加热前、后均需通入氮气,停止加热后通氮气的目的是防止倒吸和_____。
②晶体的化学式中a∶b=_____,若缺失D装置,实验测得的b值会_____(选填“偏大”、“偏小”或“不变”)。x=_____。
③请写出该红褐色固体在200℃时发生反应的总化学方程式_____。
【答案】Cl2和HCl 紫色的石蕊试液变红色,且不褪色 使产生的水蒸气和氯化氢气体分别被装置B、C完全吸收 1:2 偏大 12 Fe2(OH)2Cl412H2O![]() Fe2O3+11H2O+4HCl↑
Fe2O3+11H2O+4HCl↑
【解析】
[猜想]由质量守恒定律可知,该刺激性气味的气体可能是氯气或氯化氢气体或氯气与氯化氢气体的混合物;故填:Cl2和HCl;
(1)Cl2溶于水,形成的溶液显酸性,具有较强的漂白能力,能使石蕊溶液褪色。而氯化氢气体溶于水形成盐酸,盐酸能使紫色的石蕊试液变红色,且不褪色,证明猜想②成立;故填:紫色的石蕊试液变红色,且不褪色;
[实验]由质量守恒定律和题干信息可知,该物质分解为氧化铁、水和氯化氢气体。
①为了使产生的水蒸气和氯化氢气体分别被装置B、C完全吸收以及防止发生倒吸现象,在停止加热后要继续通一会儿氮气;故填:使产生的水蒸气和氯化氢气体分别被装置B、C完全吸收;
②装置C增重的质量即为生成氯化氢的质量,其中氯元素的质量为:14.6g×![]() ×100%=14.2g;
×100%=14.2g;
16.0g氧化铁中,铁元素的质量为:16.0g×![]() ×100%=11.2g
×100%=11.2g
则Fe2(OH)aClbxH2O中,铁元素与氯元素的质量比为:
112:35.5b=11.2g:14.2g
b=4
Fe2(OH)aClbxH2O中,铁元素显+3价,氢氧根显-1价,氯元素显-1价,根据化合物中各元素正负化合价的代数和为零可知:
(+3)×2+(-1)×a+(-1)×4=0
a=2
即:a:b=2:4=1:2
若缺失D装置,空气中的水蒸气和二氧化碳也会被装置C吸收,则实验测得的b值会偏大;
由化学反应前后,元素的种类与质量不变可知:
Fe2(OH)2Cl4xH2O--Fe2O3
288+18x 160
50.4g 16.0g
(288+18x):160=50.4g:16.0g
x=12
故填:1:2;偏大;12;
③Fe2(OH)2Cl412H2O在200℃时分解为氧化铁、水和氯化氢气体;故填:Fe2(OH)2Cl412H2O![]() Fe2O3+11H2O+4HCl↑。
Fe2O3+11H2O+4HCl↑。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:初中化学 来源: 题型:
【题目】水是宝贵的自然资源。
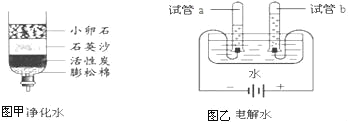
(1)保持水化学性质的最小微粒是_____;同学们对水进行如图的实验,图甲中净化水的方法是_____和_____;图乙中发生反应的化学方程式为_____;
(2)Cl2常作自来水消毒剂,其原理是:Cl2+H2O→HClO+X,则X的化学式为_____;此反应中属于氧化物的是_____(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包白色固体,可能含有氯化钠、氢氧化钠、碳酸钠、硫酸钠和硝酸钡中的一种或几种,为探究其组成,某合作学习小组设计方案并进行了如下实验:
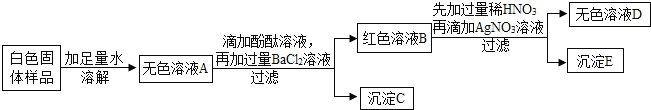
(1)小晶同学通过上述实验推知:白色固体样品中一定不含有____________(用化学式表示,下同)。
(2)为确定白色固体样品中可能存在的物质,小燕对沉淀C进行实验。
实验操作 | 现象 | 结论 |
取少量沉淀C于试管中,加入过量稀硝酸。 | ___________。 | 白色固体样品中一定含有碳酸钠和硫酸钠。 |
(3)上述实验中红色溶液B的溶质,除酚酞外,还一定含有______________________,用化学方程式表示红色溶液B变成无色溶液D的原因:_____________________________。
(4)小虎同学认为白色固体中还有物质不能确认其是否存在,经过小组讨论后得出一致意见:如要确认,只需将上述实验方案中所加的一种试剂换为另一种试剂即可,你认为修改方案为_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以石灰浆为原料制备KClO3的流程如图:
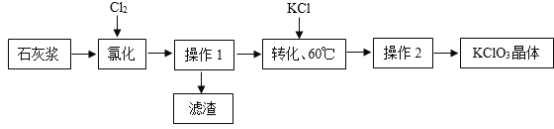
(1)过程中用石灰浆而不用石灰水的原因是______。
(2)“氯化”反应为6Ca(OH)2+6Cl2=Ca(ClO3)2+5X+6H2O.则X的化学式为______。为提高Cl2转化率,可行措施有______(填序号)。
A适当减缓通入Cl2速率 B充分搅拌浆料 C加水使Ca(OH)2完全溶解
(3)如表是60℃时相关物质的溶解度。
物质 | KCl | KClO3 | Ca(ClO3)2 | CaCl2 |
溶解度 | 43 | 24 | 62 | 70 |
转化时加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,原因是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(10分)胃酸主要成分是盐酸,正常人胃液每日需要盐酸溶质质量约为6.5g~7.3g。某患者每日分泌盐酸溶质质量为9.0g,为治疗胃酸过多需服用图9所示抑酸剂,发生反应:Mg(OH)2+2HCl=MgCl2+2H2O。请计算并回答:按说明书用法用量,每天最多可中和胃液中盐酸溶质质量是多少克?理论上能否使该患者胃液中盐酸溶质质量恢复到正常范围?(写出计算过程,结果精确到0.001)

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与能源开发
氢能源是理想能源,氢能源开发一直是前沿科学研究的课题之一。科学家研发出一种以铝镓合金(镓:Ga)和水为原料制取氢气的新工艺,流程如图2所示:
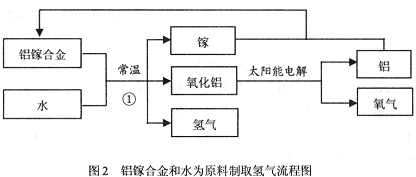
(1)从物质分类的角度看,铝镓合金属于(填“混合物”或“纯净物” ,用该合金与铝片相互刻划,发现铝片上有划痕,说明 。
(2)氢气是一种能源,它在空气中燃烧的化学方程式 。氢气被称为“绿色能源”的主要原因是 。
(3)反应①中镓的作用是 ,该反应的化学方程式 是 ,
属于四种基本反应类型中的 。与电解水制取氢气相比,用铝镓合金和水为原料制取氢气的优点是 (答出一点即) 。
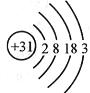
(4)镓的原子结构示意图如图所示,请写出镓与稀盐酸反应的化学方程式 ,发生有效相互作用的微粒的转化过程是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】原水(未经处理的水)中含有泥沙、悬浮物和细菌等杂质。在水中洒些明矾,可除去水中的泥沙、悬浮物,使水澄清,可用次氯酸杀死细菌。氯气溶解于水时,可生成盐酸和次氯酸。某水厂生产自来水的净化步骤如下:
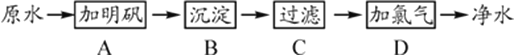
(1)可以除去大颗粒悬浮物杂质的步骤是_____。(填标号)
(2)能消毒杀菌的步骤为_____。(填标号)
(3)A步中加明矾的作用为_____。
(4)该厂生产的自来水是_____(填“纯净物”或“混合物”),其原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如右图所示。下列叙述正确的是 ( )

A. t2℃时,甲的溶解度小于乙的溶解度
B. t1℃时,甲和乙溶液中溶质质量分数相等
C. t2℃时,在100g水中放入50g甲,其溶质的质量分数为50%
D. 甲溶液中含有少量乙时,用降温结晶的方法提纯甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com