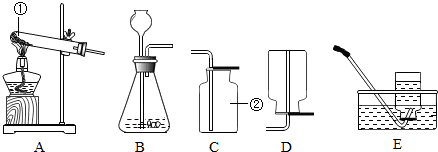
解答:解:(1)图中标号仪器的名称是:①是试管,②酒精灯;
(2)用氯酸钾与二氧化锰制取氧气,同时生了氯化钾,反应的化学方程是:2KClO
3 2KCl+3O
2↑,属于加热固体制取气体,可用A作发生装置,由于氧气谜底比空气略大,不易溶于水,可用C或D装置收集;
(3)B装置属于固液常温下反应制取氧气,可用过氧化氢和二氧化锰制取氧气;
(4)用加热高锰酸钾制取氧气时,常在试管口放一团防止高锰酸钾粉末进入导管,反应的化学表达式为:2KMnO
4 K
2MnO
4+MnO
2+O
2↑;
(5)能用D装置向上排空气法收集氧气,是由于氧气的密度略大于空气的密度.由于氧气能支持燃烧.所以,用排空气法收集的氧气验满方法是:将带火星的木条伸入瓶口处,若木条复燃,则证明氧气收集满了;
(6)实验室常用氯化铵固体与碱石灰固体共热来制取氨气,属于加热固体制取气体,应用A装置作发生装置,由于氨气密度比空气小.NH
3极易溶于水,只能用向下排空气法收集氨气,应用E装置收集氨气;
(7)①由于氨气的密度小于空气的密度,用该装置收集氨气时,氨气应从b端进入瓶中;②若将瓶中装满水,收集氢气或氧气时,由于氢气和氧气的密度小于水的密度,气体应从b管口通入瓶中;③若将瓶中装入半瓶蒸馏水可用于病人输送装置,a端连接贮氧气钢瓶,在输送的过程中,这一装置能起到的作用是观察是否有氧气输出、观察氧气的流速、湿润氧气.
[实验验证]
实验一的步骤是:将带火星的木条伸入装有过氧化氢溶液的试管中,带火星的木条不复燃,可见常温下过氧化氢分解速率很慢;
实验二、在装有过氧化氢溶液的试管中加入少量Al
2O
3,带火星的木条复燃,可见,Al
2O
3能加快过氧化氢的分解速率;
实验三:
[实验目的]由催化剂的定义可知,还要探究Al
2O
3在反应前后质量是否改变;
[实验步骤]①通过实验前后两次称量,可知实验三是探究Al
2O
3在反应前后质量是否改变.将实验二反应后的物质进行过滤可得到Al
2O
3,必须经过洗涤、烘干后才称量,减少实验数据的误差;
[提出新的问题]根据催化剂的定义,还必须在增加一个实验:探究Al
2O
3的化学性质在反应后是否改变.只有Al
2O
3具备既能改变化学反应速率,其质量和化学性质在反应前后又保持不变,才能作为过氧化氢分解的催化剂.
故答案是:(1)①是试管,②酒精灯;(2)2KClO
3 2KCl+3O
2↑,A,C,D;(3)过氧化氢,二氧化锰;(4)防止高锰酸钾粉末进入导管,2KMnO
4 K
2MnO
4+MnO
2+O
2↑;(5)氧气的密度略大于空气的密度.将带火星的木条伸入瓶口处,若木条复燃,则证明氧气收集满了;(6)AE;(7)b,b,a,观察是否有氧气输出、观察氧气的流速、湿润氧气.
[实验验证]
| |
实验步骤 |
实验现象 |
实验结论 |
| 实验一 |
将带火星的木条伸入装有过氧化氢溶液的试管中 |
|
|
| 实验一 |
|
|
加入Al2O3能加快过氧化氢溶液的分解速率 |
实验三:[实验目的]探究Al
2O
3在反应前后质量是否改变;实验步骤]干燥;(5)Al
2O
3在反应前后质量是否改变;干燥[提出新的问题]Al
2O
3的化学性质在反应前后是否改变.

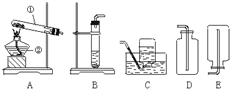 下面是实验室制取氧气的装置图,根据装置图回答下列问题:
下面是实验室制取氧气的装置图,根据装置图回答下列问题: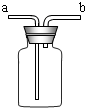


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案