
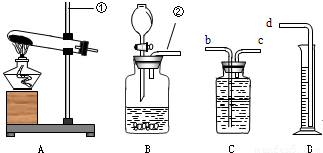
| 装置A | 装置B | |
| 反应物状态 | ______ | ______ |
| 反应条件 | ______ | ______ |
| 装置A | 装置B | |
| 应物状态和反应条件 | 固体 需加热 | 液体(或液体和固体), 不需加热 |
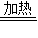 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑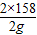 =
=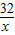
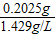 =0.14L
=0.14L

科目:初中化学 来源: 题型:阅读理解
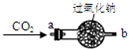
| 实 验 操 作 | 实 验 现 象 |
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的气体通入澄清石灰水中 | 有气泡产生, 石灰水变浑浊 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 超市中的许多食物用保鲜膜包装后出售.保鲜膜为什么可以“保鲜”呢?
超市中的许多食物用保鲜膜包装后出售.保鲜膜为什么可以“保鲜”呢?| 实验前 | 实验后 | |
| B装置的 质量/g |
213.6 | 220.8 |
| C装置的 质量/g |
200.2 | 217.8 |
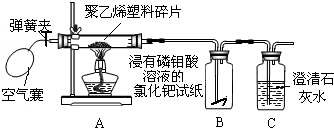
| 实验步骤 | 实验现象 | 实验结论及化学方程式 |
| 点燃酒精灯加热,随即打开弹簧夹,通入干燥的空气.观察装置B、C中的现象 | 装置B中的现象是: 装置C中的现象是: |
聚乙烯塑料在空气中燃烧,生成物中,既有CO2,也有CO.装置C中反应的化学方程式为: |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 高温 |
| 高温 |

| 实 验 现 象 | 实 验 结 论 |
| ①A中固体由 黑 黑 色变为红 红 色②B中黄色试纸变蓝 ③C中溶液变 浑浊 浑浊 ④不断通入二氧化碳,C中又可观察到 变澄清 变澄清 |
①有铜生成 ②有 CO CO 生成③有二氧化碳生成,反应的化学方程式 Ca(OH)2+CO2=CaCO3↓+H2O Ca(OH)2+CO2=CaCO3↓+H2O ④反应后生成新物质 碳酸氢钙 碳酸氢钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
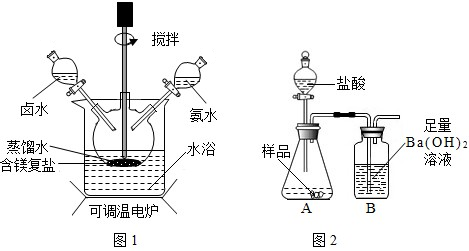
| 实 验 操 作 | 实验现象 | 实验结论 |
| ①取样溶解,向样品溶液中滴加过量稀硝酸. ②再向上述所得溶液加 硝酸银 硝酸银 溶液 |
现象① 有气泡产生 有气泡产生 ;现象② 有白色沉淀生成 有白色沉淀生成 ; |
含有Cl- |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 实验探究让化学更具魅力,请帮助完成下列实验探究
实验探究让化学更具魅力,请帮助完成下列实验探究| 白色粉末的成分 | 形 成 的 原 因 |
| 可能是CaCO3 | 石灰水与空气中CO2反应: 化学方程式为: CO2+Ca(OH)2=CaCO3↓+H2O CO2+Ca(OH)2=CaCO3↓+H2O |
| 可能是 Ca(OH)2 Ca(OH)2 |
随着气温的升高,溶质的溶解度会 变小 变小 填变大或变小)或溶剂蒸发,石灰水中的溶质析出 |
| 实 验 步 骤 | 可能观察到的现象 | 结 论 |
| 取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | 溶液变红 | 白色粉末中含Ca(OH)2 白色粉末中含Ca(OH)2 |
| 往上述试管内残留的固体中加入稀盐酸 | 产生气泡 产生气泡 |
白色粉末中含有CaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com