
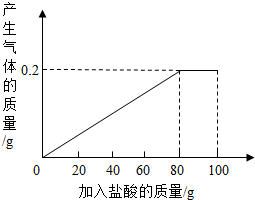
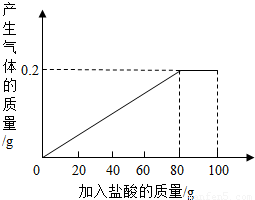
 有一种部分锈蚀的生铁样品,其成分是Fe、Fe2O3和C,课外小组的同学将100g稀盐酸分5次加到7.4g样品中(已知C不与稀盐酸反应,也不溶于水),充分反应后过滤、烘干得到滤渣0.2g,并将相关数据绘制如图.请计算:
有一种部分锈蚀的生铁样品,其成分是Fe、Fe2O3和C,课外小组的同学将100g稀盐酸分5次加到7.4g样品中(已知C不与稀盐酸反应,也不溶于水),充分反应后过滤、烘干得到滤渣0.2g,并将相关数据绘制如图.请计算:| 56 |
| x |
| 73 |
| z |
| 127 |
| y |
| 2 |
| 0.2g |
| 盐酸溶质的质量 |
| 盐酸溶液的质量 |
| 7.3g |
| 80g |
| 氯化亚铁的质量 |
| 反应后溶液的总质量 |
| 12.7g |
| 107g |


科目:初中化学 来源: 题型:解答题
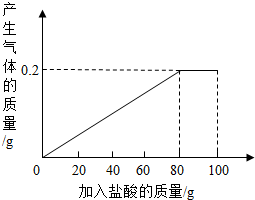 有一种部分锈蚀的生铁样品,其成分是Fe、Fe2O3和C,课外小组的同学将100g稀盐酸分5次加到7.4g样品中(已知C不与稀盐酸反应,也不溶于水),充分反应后过滤、烘干得到滤渣0.2g,并将相关数据绘制如图.请计算:
有一种部分锈蚀的生铁样品,其成分是Fe、Fe2O3和C,课外小组的同学将100g稀盐酸分5次加到7.4g样品中(已知C不与稀盐酸反应,也不溶于水),充分反应后过滤、烘干得到滤渣0.2g,并将相关数据绘制如图.请计算:查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:初中化学 来源:2008-2009学年重庆一中九年级(下)月考化学试卷(3月份)(解析版) 题型:解答题
查看答案和解析>>
科目:初中化学 来源:2011年专题训练:溶质质量分数与化学方程式的综合计算(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com