
| A. | 一定是烧碱溶液 | B. | 一定是酸溶液 | C. | 可能是中性溶液 | D. | 一定是盐溶液 |
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:初中化学 来源: 题型:选择题
| A. | 甲醛分子中含有水分子 | |
| B. | 甲醛和苯都属于无机化合物 | |
| C. | 苯中碳元素与氢元素的质量比为1:1 | |
| D. | 甲醛中碳元素质量分数为40% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ③属于置换反应 | |
| B. | 上述反应中生成了三种可燃性气体 | |
| C. | 硅不属于金属材料 | |
| D. | Si和SiO2在一定条件下可以相互转化 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
 实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )| A. | 该实验是将氢氧化钠溶液滴入盐酸中 | |
| B. | B 点表示盐酸和氢氧化钠恰好完全反应 | |
| C. | C 点时的溶液能使酚酞试液变红 | |
| D. | A 点时,溶液中的溶质有氯化钠和氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
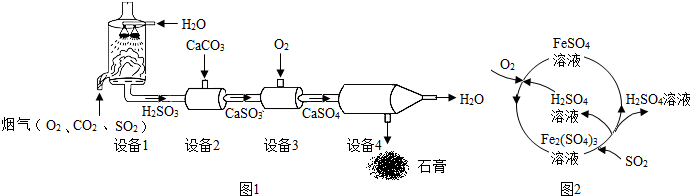
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
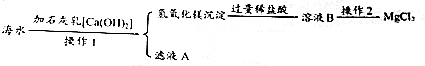
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
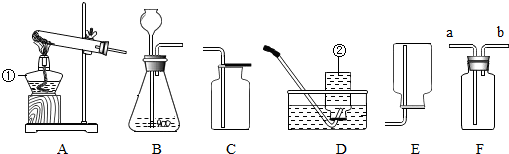
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com