K2CO3是草木灰的主要成分.
(1)2molK2CO3的质量为______g,含钾原子的个数为______个.
(2)将50g草木灰样品溶于水中(假设杂质都不溶于水),通过______方法可得到k2CO3溶液,用pH试纸测K2CO3溶液的酸碱性,将得出pH______7(填“大于”、“等于”或“小于”),再通过实验去除水分,得到20gK2CO3固体,则原草木灰样品的纯度为______.
(3)请你通过实验的方法,验证(2)中得到的固体是K2CO3.实验操作为______
.
解:(1)2molK
2CO
3的质量为276g,含钾原子的个数为2.408×10
24个.故填:276;2.408×10
24.
(2)通过过滤可以不把碳酸钾中的不溶于水的物质除去,碳酸钾溶液显碱性,PH大于7.故填:过滤;>.
原草木灰样品的纯度为:
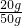
×100%=40%.故填:40%.
(3)验证(2)中得到的固体是K
2CO
3的实验操作为:取少量固体进行焰色反应,若通过蓝色钴玻璃片观察到紫色火焰,证明固体中含有钾元素.再取适量固体加入简易启普发生器中,滴入稀盐酸(或稀硫酸),将产生的气体导入澄清石灰水中,若澄清石灰水变浑浊,则证明原固体是碳酸钾.
分析:每摩尔任何物质含有6.02×10
23个微粒;物质的摩尔质量在数值上等于该物质的相对分子质量;过滤可以除去不溶于水的物质;根据质量分数的含义可以减小相关方面的计算;碳酸盐和显酸性的物质反应能生成使石灰水变浑浊的二氧化碳气体.
点评:解答本题要掌握物质的量的概念和相关方面的计算方法,只有这样才能对相关方面的问题做出正确的判断.

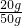 ×100%=40%.故填:40%.
×100%=40%.故填:40%.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案