
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀盐酸质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
分析 (1)根据金属活动性可知,铜排在氢后,不能与稀盐酸发生反应,故发生反应的是锌,减少的固体的质量就是参加反应的锌的质量,由题目可知:第二次反应消耗锌的质量=9.10g-8.45g=0.65g;
(2)利用第二次实验所消耗锌的量,根据反应的化学方程式,计算出所加10g稀盐酸中溶质的质量,由溶质的质量分数公式,求出所用稀盐酸中溶质的质量分数;
(4)根据加水稀释前后溶液中溶质质量不变,由40g7.3%的稀盐酸中溶质质量与浓盐酸的质量分数的比计算需要浓盐酸的质量;
(5)根据第四次实验数据可知,剩余的7.80g固体即为样品中铜的质量,铜的质量与样品质量比可计算出黄铜样品中铜的质量分数,而样品的质量=9.10g+0.65g=9.75g.
解答 解:(1)Zn的质量=0.65g×3=1.95g
Zn-----H2↑
65 2
1.95g 0.6g
所以生成氢气是0.6g;
(2)设10g稀盐酸中HCl的质量为y
Zn+2HCl═ZnCl2+H2↑
65 73
0.65g y
$\frac{65}{0.65g}$=$\frac{73}{y}$
y=0.73g
所用稀盐酸中溶质的质量分数=$\frac{0.73g}{10g}$×100%=7.3%
(3)需要浓盐酸的质量=$\frac{40g×7.3%}{36.5%}$=8g
(4)由第二次实验可知,第一次加入10g稀盐酸时,反应消耗锌的质量为0.65g,则原黄铜样品的质量=9.10g+0.65g=9.75g;由第四次实验可知,样品中铜的质量7.8g
黄铜样品中铜的质量分数=$\frac{7.8g}{9.75g}$×100%=80%.
故答案为:(1)0.6;
(2)7.3%;
(3)8g;
(4)80%.
点评 分析每次加入10g稀盐酸固体剩余物质量的变化,可对反应进行的情况进行判断,这是解决本题的基础.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
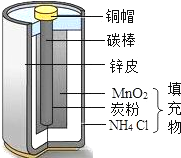 生活中处处有化学.
生活中处处有化学.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
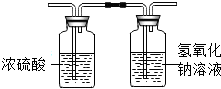 某气体由H2、CO、CH4中的一种或几种组成,点燃该气体后,将所得气体依次通过如图装置,测得两装置的质量均增加,则下列对该气体成分的推断不正确的是( )
某气体由H2、CO、CH4中的一种或几种组成,点燃该气体后,将所得气体依次通过如图装置,测得两装置的质量均增加,则下列对该气体成分的推断不正确的是( )| A. | 可能只有CH4 | B. | 可能只有H2 | ||
| C. | 可能是CO和CH4 | D. | 可能三种气体都存在 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
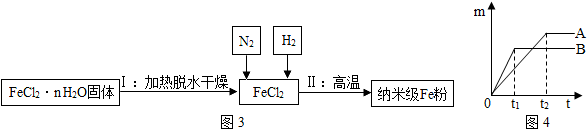
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
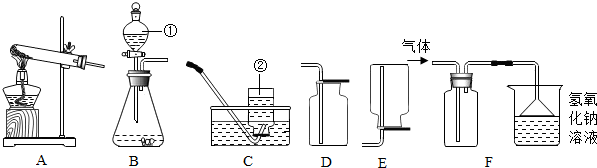
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生石灰、烧碱、浓硫酸都可以用作干燥剂 | |
| B. | 铁、锌、碘元素都属于人体必需微量元素 | |
| C. | CH4、C2H5OH、CH3COOH 都属于有机化合物 | |
| D. | KNO3、CO(NH2)2、NH4H2PO4 都属于复合肥料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com