
【题目】碳酸镁晶须(MgCO3·nH2O,n = 1~5的整数)是一种新型吸波隐形材料中的增强剂。
(查阅资料)(1) MgCO3·nH2O微溶于水;
(2) MgCO3·nH2O在230℃时开始失去结晶水, 400℃以上时开始分解生成三种氧化物。
I.合成碳酸镁晶须
步骤:①配制一定溶度的MgSO4溶液和NH4HCO3溶液;②量取一定量的NH4HCO3溶液于容器中,搅拌并逐滴加入MgSO4溶液,控制温度50℃,反应一段时间;③用氨水调节溶液pH至9.5,放置1h后,过滤、洗涤、干燥得碳酸镁晶须产品。
(1)步骤①配制一定溶质质量分数的MgSO4溶液所需要的玻璃仪器有烧杯、胶头滴管、玻璃棒、______________;
(2)步骤②反应的温度控制在50℃,较好的加热方法是__________;
(3)氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3·nH2O沉淀外,同时生成的产物还有______________;
(4)检验沉淀已洗涤干净的方法是:取最后一次洗涤的滤液,滴入_________,若无沉淀说明已洗涤干净。
(5)干燥得碳酸镁晶须产品温度不能过高,目的是______________。
II.测定产品MgCO3.nH2O中的n值
(方案一)将碳酸镁晶须放入A装置中加热(仪器和装置如下图所示),回答下列问题:
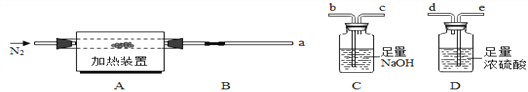
(6)上述装置的连接顺序为_____(按气流方向,用接口字母表示),其中B处的长玻璃导管的作用是__________,C装置的作用是__________。
(7)加热前先通入N2排尽装置中的空气,然后称取C、D的初始质量。再次连接好装置,边加热边通入N2,此时通入N2的作用是_____________。
(8)若B装置中无残留物。装置C反应前后质量差为m1,装置D反应前后质量差m2 。根据以上实验数据,确测定n值, n=___(用含m1、m2的代数式表示)。
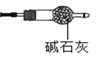
(9)有同学提出上述连接好的装置仍不够完善。需要在D装置的后面连接下图装置,目的是________________,否则测得n值会________(“偏大”、“偏小”、“无影响”) 。
(方案二)
称量100g碳酸镁晶须放入如下图所示的广口瓶中,加入水,滴入稀硫酸与晶须反应,生成的CO2被过量NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后,烧杯中的溶液加入已知浓度的盐酸恰好完全反应,测得CO2的总量;重复上述操作2次。
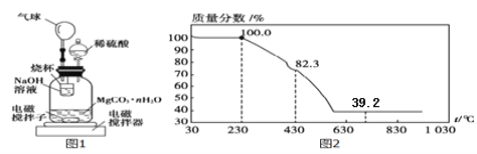
(10)氢氧化钠吸收二氧化碳的化学反应方程式____________________;
(11)图中气球的作用是__________________;
(12)上述反应后期要升温到30℃,主要目的是______________;
(13)设3次实验测得每100 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为ag,则n值为_______(用含a的代数式表示);
(14)称取100g上述晶须产品进行热重分析,热重曲线如图2,则该条件下合成的晶须中,n=_______(写出过程)。
【答案】 量筒 水浴加热 (NH4)2SO4 BaCl2溶液 防止晶体失去结晶水 a→e→d→b→c 冷却气体 吸收二氧化碳气体 生成的二氧化碳和水完全被C、D装置吸收、防止倒吸 22m2/9m1 防止空气中的二氧化碳进入C装置,影响实验结果 偏小 2NaOH+CO2=Na2CO3+H2O 缓冲作用 使广口瓶内水中溶解的CO2充分逸出,并被NaOH充分吸收 (4400-84a)/18a 1
【解析】(1)根据配制溶液步骤:计算、称量、溶解、转移等,需要的仪器有:托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管等,其中玻璃仪器为:烧杯、量筒、玻璃棒、胶头滴管;
(2)加热温度低于100℃需要水浴加热控制温度;
(3)氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3nH2O沉淀外,还生成硫酸铵;
(4)检验沉淀已洗涤干净的方法是取最后一次洗涤的滤出液少许,滴入盐酸酸化的BaCl2溶液,若无沉淀说明已洗涤干净,若有沉淀则说明未洗涤干净;
(5)由于碳酸镁晶须高温会失去结晶水,所以干燥得碳酸镁晶须产品温度不能过高;
(6)上述装置的连接顺序为:应该首先通过D装置吸收水蒸气,后通过C装置吸收二氧化碳;将气体通过洗气瓶进行洗气时,应该从长导管一侧通入气体,故其连接顺序是a→e→d→b→c;装置C的作用是吸收反应生成的二氧化碳气体,装置D的作用是吸收水蒸气,装置B是长玻璃管起到冷却作用;
(7)因为加热后的装置中含有残留的HCl和水蒸气,为了避免引起实验误差,保证反应产生的气体全部被装置C、D吸收,所以要通入N2排出装置内残留的气体,同时也是为了防止产生倒吸;
(8)若B装置中无残留物,通过装置D吸收的质量为生成水的质量,装置C吸收的是分解生成的二氧化碳的质量,可以计算,![]() =1:n,n=
=1:n,n= ![]() ;
;
(9)防止空气中的二氧化碳进入C装置,使m1偏大,测得n值会偏小,所以需要在D装置的后面连接装有碱石灰的干燥管;
(10)氢氧化钠与二氧化碳反应生成碳酸钠和水,化学反应方程式为:2NaOH+CO2=Na2CO3+H2O;
(11)气球的作用是缓冲装置中的压强作用;
(12)要使广口瓶内水中溶解的CO2充分逸出,并被NaOH充分吸收,上述反应后期要升温到30℃;
(13)实验测得每100g碳酸镁晶须产生的CO2平均值为a g,依据化学方程式可知,碳酸镁物质的质量为![]() g,根据化学式可知,MgCO3nH2O中碳酸镁晶体中碳酸镁和结晶水物质的量之比为1:n,得到1:n=
g,根据化学式可知,MgCO3nH2O中碳酸镁晶体中碳酸镁和结晶水物质的量之比为1:n,得到1:n=![]() :
:![]() ,得到n=
,得到n=![]() ;
;
(14)MgCO3nH2O n=1~5,分析图象430°C剩余质量为82.3g,为失去结晶水的质量,剩余质量为39.2g是碳酸镁分解失去二氧化碳的质量,得到100g×![]() =100g-82.3g,解得:n=1。
=100g-82.3g,解得:n=1。


科目:初中化学 来源: 题型:
【题目】图1是初中化学的几种常用仪器,根据要求回答问题:

(1)写出仪器C的名称________.
(2)实验室用过氧化氢溶液制取氧气,应选用的仪器是_____(填字母序号),反应的化学方程为_____________;若用稀盐酸制取二氧化碳气体,还需要的药品为________________,检验二氧化碳气体已集满的方法是_____________________________________.
(3)小明为了用图2装置收集一定量的氧气,装置接口连接的顺序为____,量筒的作用_____________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“单中心铁”可作某反应的高效催化剂,该转化的微观示意图如下:
[Failed to download image : http://qbm-images.oss-cn-hangzhou.aliyuncs.com/QBM/2017/6/6/1702992527302656/1705087062491136/STEM/4144230418c3411da58a061e73241c71.png]
“![]() ”和“”表示不同元素的原子
”和“”表示不同元素的原子
有关该转化的说法不正确的是
A. 该反应为分解反应 B. 反应前后原子总数一定没有发生变化
C. 图中涉及三种化合物 D. “单中心铁”在反应前后质量和化学性质没有改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】肼(N2H4)是氮和氢形成的化合物,易溶于水。工业上利用尿素法生产肼,同时得副产品十水碳酸钠,工艺流程如下:
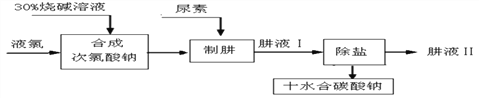
(资料)①尿素的化学式为CO(NH2)2; ②Cl2+H2O==HCl+HClO;
③制肼过程的反应为CO(NH2)2+NaClO+2NaOH==N2H4+Na2CO3+NaCl+H2O;
下列说法不正确的是
A. 尿素不能与熟石灰、草木灰等碱性物质混合使用,会生成氨气,造成肥效流失
B. Cl2与NaOH溶液发生反应的化学方程式为Cl2+2NaOH==NaCl+NaClO+H2O
C. 从母液中分离出十水合碳酸钠晶体,可采用蒸发浓缩、冷却结晶、过滤、洗涤干燥等步骤
D. 从后续反应过程来看,若要使原料利用率最佳,合成次氯酸钠时投入的液氯与烧碱的质量之比为71 :80
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业废料石膏(CaSO42H2O)可以“变废为宝”,用于生产氧化钙、硫酸钾、电石(化学名称为碳化钙)等。某研究性学习小组展开了如下系列研究。
一、高纯CaO的制备
【资料一】
Ⅰ.石膏(CaSO42H2O)与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物。
Ⅱ.SO2能使品红溶液褪色,也能使澄清石灰水变浑浊。
甲同学用如图1装置制备CaO并验证石膏与焦炭高温反应的其他产物。
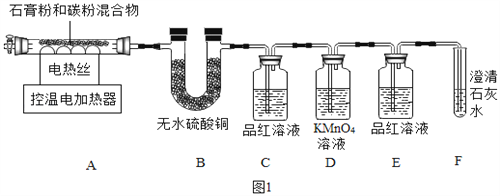
实验过程中发现:B中无水硫酸铜变蓝;C中产生__现象证明有SO2生成;装置__中无明显变化和装置F中__现象证明有CO2生成。写出石膏与碳粉在高温条件下反应的化学方程式:____。
二、硫酸钾和电石的制备
乙同学模拟生产化肥硫酸钾和电石的流程如图2:
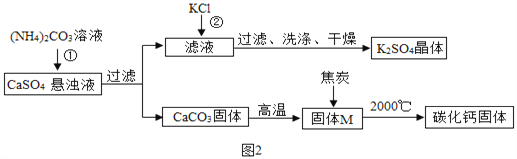
【资料二】CaO与C在高温下反应生成碳化钙(化学式为CaCx)和CO。
(1)反应①的化学方程式为___。证明固体M中不含CaCO3的方法是____(写出实验的方法、现象)。
(2)反应②的化学方程式为(NH4)2SO4+2KCl═K2SO4↓+2NH4Cl,该反应能析出K2SO4晶体的原因是__。
三、假设上述流程中制得的碳化钙(化学式为CaCx)固体中只含杂质CaO,乙小组同学为测定CaCx中x的值进行如下实验。
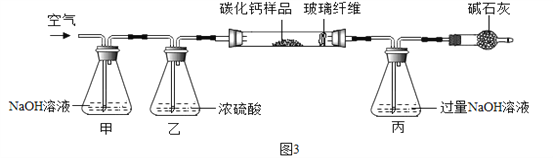
【资料三】CaCx在空气中灼烧生成CaO和CO2。
步骤一:称取3.76g样品于图3所示石英管中(测定装置图如图3,夹持及加热装置省略),反应前缓缓通入空气,高温灼烧石英管中的样品至反应完全后继续缓缓通入空气,测得丙溶液的质量比反应前增重了4.4g。(玻璃纤维可防止固体粉末进入导管)
步骤二:将石英管内剩余固体全部转移到水中,加入足量碳酸钠溶液,经搅拌、过滤、洗涤、干燥等操作得到碳酸钙固体6克。试回答下列问题:
(1)装置甲的作用是__。反应完全后继续缓缓通入空气的目的是__。
(2)根据步骤一、二计算该样品中钙、碳、氧的质量比为___,
计算确定CaCx的化学式(请写出计算过程)______________。
(3)若碳酸钙未能完全干燥,则会导致CaCX中的x的值____(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某研究性学习小组设计的几种装置,请你分析并回答下列问题:
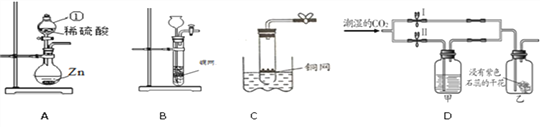
(1)图A中仪器①名称为________,发生反应的化学方程式为______________;
(2)用浓硫酸(溶质质量分数为98%,密度为1.84 g/mL)和水按照体积比为1︰10配制该实验所需的稀硫酸,所得稀硫酸的溶质质量分数约为________(保留到0.1%)。若对稀硫酸进行如下操作,溶液的pH因化学变化而升高的有______(填字母序号);
a.加少量水 b.加少量铁粉 c.加少量浓硫酸
(3)装置B是实验室常见的气体发生装置。源源同学从装置B得到启发,又用一支底部有一个小洞的试管和矿泉水瓶组合成装置C(夹持仪器都略去),用来制取二氧化碳,则C与B相比都具有的优点是__________,用装置B或C制取二氧化碳的化学反应方程式为___________;
(4)用装置D探究CO2的部分性质,若关闭Ⅱ阀,打开Ⅰ阀,紫色小花(用石蕊溶液染成)变红;若关闭Ⅰ阀,打开Ⅱ阀,紫色小花不变红,则甲瓶中所盛的试剂可能是______(填序号)。
①浓H2SO4 ②浓NaOH溶液 ③饱和NaCl溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】素有“铜都”之称的安徽铜陵有许多黄铜矿(主要成分为CuFeS2)。黄铜矿经初步 处理后,所得溶液甲中的溶质为 Fe2(SO4)3、CuSO4及H2SO4。某同学通过废铁屑与溶液甲反 应,制取补血剂原料碳酸亚铁并回收铜。主要步骤如图所示:
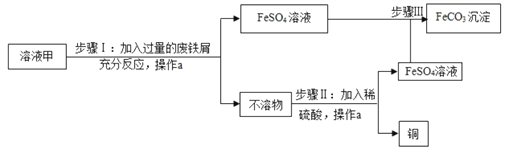
(1)Fe2(SO4)3与铁反应的化学方程式如下,请配平:xFe2(SO4)3+yFe=zFeSO4,其中x、y、z为化学计量数,z的值为_____;
(2)步骤Ⅰ中,生成铜的化学方程式:_________。废铁屑含有少量铁锈,对产物的成分没有影响,原因是_____;
(3)操作a名称为_____,为提高操作a的速率,可以采取的方法有_____;
(4)不溶物的成分为_____ (填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现取8.0 g石灰石样品放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5 g时,烧杯内物质总质量为42.3 g(气体全部逸出),产生气体的质量与加入的稀盐酸的质量关系如图所示。(友情提示:石灰石样品中的杂质不溶于水,也不发生反应)试计算 :
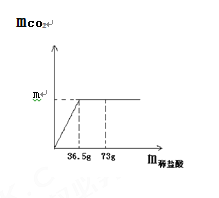
(1)m = ________。
(2)该石灰石样品中碳酸钙的质量分数是多少__________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法错误的是( )
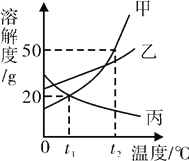
A. t1℃时,甲和丙的溶解度都为 20g
B. 通过冷却热饱和溶液,可以分离甲中混有的少量乙
C. t2℃时,60g 甲加到 100g 水中,能得到 150g 饱和溶液
D. 将 t2℃甲、乙、丙的饱和溶液分别降温到 t1℃,所得溶液的溶质质量分数大小顺序为:乙>甲=丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com