

分析 (1)熟记常见仪器的名称;
(2)气体的发生装置选择的依据是药品的状态和发生的条件两个因素;
(3)氧气的密度比空气大,不易溶于水;
(4)氯酸钾(KClO3)在二氧化锰(MnO2)作催化剂并加热的条件下能较快地生氯化钾(KCl)和氧气,写出反应的化学方程式即可;
(5)若在KClO3中加少量的KMnO4,也能加快KClO3的分解,是因为KMnO4受热分解生成二氧化锰,生成的二氧化锰做了氯酸钾的催化剂;
(6)①根据反应原理来分析;②根据CO2密度比空气大,能溶于水解答;③选择气体收集的方法根据CO2气体的密度选择向上排空气法解答.
解答 解:(1)仪器a是铁架台,b是集气瓶;故填:铁架台;集气瓶;
(2)氢气、氧气、二氧化碳都可用固体和液体常温下反应制取,故选用固液混合不加热装置,故填:B;
(3)因为氧气的密度比空气大,可以用向上排空气法收集,即用D装置收集,氧气不易溶于水,可以用排水法收集,即用E装置收集.故填:D或E;
(4)氯酸钾(KClO3)在二氧化锰(MnO2)作催化剂并加热的条件下能较快地生氯化钾(KCl)和氧气,反应的化学方程式为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.
故答案为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.
(5)若在KClO3中加少量的KMnO4,也能加快KClO3的分解,是因为KMnO4受热分解生成二氧化锰,生成的二氧化锰做了氯酸钾的催化剂;故答案为:KMnO4受热分解生成二氧化锰,生成的二氧化锰做了氯酸钾的催化剂;
(6)①碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,故答案为:D;
③如图把集气瓶内的导管补充完整:左边的导管伸到集气瓶底即可.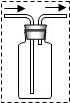
故本题答案为:
点评 本题主要考查仪器的用途、化学方程式的书写,实验装置的选择,选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、能否和水发生化学反应、密度、能否和空气中的物质发生化学反应等因素.


 学习实践园地系列答案
学习实践园地系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 4.08g | B. | 8.17g | C. | 12.26g | D. | 16.34g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 18gMg、18gCu | B. | 20gCaO、20gCaCO3 | ||
| C. | 10gAgNO3溶液、5gCu(OH)2 | D. | 4gMg(OH)2、8.4gMgCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com