解:(1)石灰石样品与100g稀盐酸恰好完全反应后,余下物质质量为108.1g,求生成CO
2气体的质量(或求石灰石样品的纯度)(答案合理即可得分)
CO
2的质量=12.5g+100g-108.1g=4.4g
设样品中碳酸钙的质量是x
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 44
x 4.4g
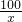
=

x=10g
石灰石样品的纯度是:
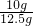
×100%=80%
答:生成CO
2气体的质量是4.4g,石灰石样品的纯度是80%
(2)(3)设参加反应的盐酸溶质的质量是Y、生成氯化钙的质量是Z
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
73 111 44
Y Z 4.4g
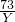
=

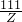
=

Y=7.3g Z=11.1g
所以稀盐酸的溶质质量分数是:

%=7.3%
氯化钙溶液的质量是108.1g-(12.5g-10g)=105.6g
所以氯化钙溶液的溶质质量分数是:
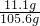
×100%=10.5%
答:稀盐酸的溶质质量分数是7.3%,反应后所得溶液的溶质质量分数是10.5%.
分析:(1)根据题意找出已知量和未知量,已知量是石灰石12.5g,稀盐酸100g,反应后余下物质的质量是108.1g,可以求生成CO
2气体的质量(或求石灰石样品的纯度);
(2)首先根据根据质量守恒定律求出二氧化碳的质量,然后代入方程式求出求出稀盐酸中溶质的质量,再依据溶质的质量分数计算公式求解;
(3)反应后溶液是氯化钙溶液,溶质是氯化钙,首先代入二氧化碳的质量求出氯化钙的质量,氯化钙溶液的质量=余下物质的质量-石灰石中杂质的质量,再根据溶质的质量分数计算公式求解.
点评:本题较好地考查了学生应用知识的能力,要先根据所给信息自拟一道有关化学方程式的计算题,然后进行解答,并考查了溶质质量分数的计算,有一定思维难度,解题关键是根据图示找出已知量和未知量,然后求出二氧化碳的质量,并进行解答.


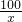 =
=
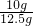 ×100%=80%
×100%=80%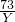 =
=
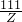 =
=
 %=7.3%
%=7.3%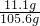 ×100%=10.5%
×100%=10.5%