

分析 (1)根据氯化钙和碳酸钠反应生成氯化钠和碳酸钙沉淀进行分析;
(2)根据澄清石灰水增加的质量就是二氧化碳的质量,然后依据化学方程式计算参加反应的碳酸氢钠的质量;
(3)根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,依据沉淀的质量计算参加反应的氯化钙的质量,然后计算氯化钙的质量分数;
(4)根据碳酸氢钠生成碳酸钠的质量和参加反应的碳酸钠的总质量计算混合物中碳酸钠的质量分数;
(5)根据反应后溶液的质量和溶质质量计算溶质质量分数;
(6)根据溶液稀释前后溶质质量不变进行分析.
解答 解:(1)氯化钙和碳酸钠反应生成氯化钠和碳酸钙沉淀,化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl;
(2)设参加反应的碳酸氢钠的质量为x,生成碳酸钠质量为z
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
168 106 44
x z 0.44g
$\frac{168}{x}$=$\frac{44}{0.44g}$=$\frac{106}{z}$
x=1.68g
z=1.06g
(3)设参加反应的氯化钙的质量为y,消耗碳酸钠质量为m,生成氯化钠质量为n
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
y m 15g n
$\frac{111}{y}$=$\frac{100}{15g}$$\frac{106}{m}$=$\frac{117}{n}$
y=16.65g
m=15.9g
n=17.55g
所以加入氯化钙溶液的溶质的质量分数为$\frac{16.65g}{150g}$×100%=11.1%;
(4)所以纯碱样品中纯碱的质量分数为:$\frac{15.9g-1.06g}{20g}$×100%=74.2%;
(5)所以反应后溶质质量为:17.55g+20g-1.68g-(15.9g-1.06g)=21.03g,
溶液质量为:15.9g+145.62g+150g-15g=296.52g,
所以实验最终所得的溶液中溶质的质量分数为:$\frac{21.03g}{296.52g}$×100%=7.1%;
(6)所需的33.3%氯化钙溶液的质量:$\frac{16.65g}{33.3%}$=50g,需要水的质量为:150g-50g=100g,所以所需的33.3%氯化钙溶液的质量和加入水的质量比为:1:2.
故答案为:(1)CaCl2+Na2CO3=CaCO3↓+2NaCl;
(2)$\frac{168}{x}$=$\frac{44}{0.44g}$;
(3)11.1%;
(4)74.2%;
(5)7.1%;
(6)1:2.
点评 本题主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 如图为某反映的示意图,其中
如图为某反映的示意图,其中 分别表示不同元素的原子.下列说法中错误的是( )
分别表示不同元素的原子.下列说法中错误的是( )| A. | 该反应类型为分解反应 | |
| B. | 该反应的生成物中一定有单质 | |
| C. | 该反应的反应物和生成物都可能有氧化物 | |
| D. | 不考虑反应条件时,该图示可以表示电解水的反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图中A-F分别表示一种常见化合物,A、B都是氧化物,A通常为气态,F常用于实验室制取A(部分生成物已略去).
如图中A-F分别表示一种常见化合物,A、B都是氧化物,A通常为气态,F常用于实验室制取A(部分生成物已略去).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
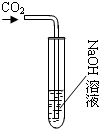 化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.新
化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.新| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量大试管中的溶液于试管中,加入足量CaCl2溶液,过滤 ②向滤液滴加适量酚酞 | ①产生白色沉淀 ②溶液变红 | 贝贝的猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金刚石做玻璃刀--------金刚石硬度大 | |
| B. | 石墨做电池电极---------石墨很软 | |
| C. | 不锈钢做水壶----------不锈钢有导热性 | |
| D. | 钛合金制造船舶设备---------钛合金抗腐蚀性强 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 7克 | B. | 9克 | C. | 14克 | D. | 28克 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 科学兴趣小组学习了二氧化锰(MnO2)催化分解过氧化氢的实验后,进行如下实验.
科学兴趣小组学习了二氧化锰(MnO2)催化分解过氧化氢的实验后,进行如下实验.| 时间/秒 | 生成氧气的体积/毫升 | |||
| 0.1克MnO2 | 0.2克MnO2 | 0.3克MnO2 | 0.4克MnO2 | |
| 40 | 49 | 61 | 75 | 86 |
| 80 | 77 | 87 | 90 | 92 |
| 120 | 89 | 92 | 92 | 92 |
| 160 | 92 | 92 | 92 | 92 |
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com