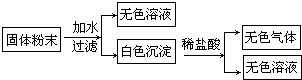
有一包固体粉末样品,含有Na2CO3、CaCO3、Zn三种物质.为进一步确定其组成,某实验小组进行了以下探究活动.
【思考与交流】
(1)上述物质中,能溶于水的是______(填化学式).
(2)它们均能与盐酸反应,写出锌与盐酸反应的化学方程式______.
【活动与探究】
经过讨论,他们设计并完成了下列实验:
(3)用托盘天平(1g以下用游码)称取37.7g样品.称量时砝码应置于______(填“左”或“右”)盘,则所称固体的实际质量为______g.
(4)往37.7g样品中加入足量稀盐酸,可观察到产生大量气体,其组成为氢气和______(填化学式.注意:少量氯化氢和水蒸气忽略不计);将所得气体缓慢通入足量氢氧化钠溶液中,待反应完全后,称得该溶液增重13.2g;再将剩余气体通过足量灼热氧化铜粉末,充分反应后冷却称重,发现该粉末反应后比反应前减轻1.6g.
【分析与总结】
(5)上述过程中氧化铜粉末减轻1.6g是由于氢气与氧化铜反应所致,该反应的化学方程式为______,由此可推知反应中氢气的质量为______g.
(6)根据以上数据计算并确定37.7g样品中三种物质的质量.
解:(1)上述物质中,能溶于水的是碳酸钠,化学式是Na
2CO
3.
故填:Na
2CO
3.
(2)锌与盐酸反应能生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl
2+H
2↑.
故填:Zn+2HCl═ZnCl
2+H
2↑.
(3)称量时砝码应置于右盘,则所称固体的实际质量为37.7g.
故填:右;37.7.
(4)往37.7g样品中加入足量稀盐酸,可观察到产生大量气体,其组成为氢气和二氧化碳,二氧化碳的化学式是CO
2.
故填:CO
2.
(5)氧化铜和氢气在加热条件下反应能生成铜和水,反应的化学方程式为:CuO+H
2
Cu+H
2O.
故填:CuO+H
2
Cu+H
2O.
由氧化铜和氢气反应的化学方程式可知,当参加反应的氢气的质量是2份时,固体质量减少的是16份,
设氢气的质量为X,
则有:2:16=X:1.6g,
X=0.2g.
故填:0.2.
(6)设锌的质量为Y,
Zn+2HCl═ZnCl
2+H
2↑,
65 2
Y 0.2g
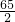
=
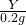
,
Y=6.5g,
将所得气体缓慢通入足量氢氧化钠溶液中,待反应完全后,称得该溶液增重13.2g,说明生成的二氧化碳的质量是13.2g,
碳酸钙和碳酸钠的质量和为:37.7g-6.5g=31.2g,
设碳酸钙的质量为m,生成二氧化碳的质量为n,
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑,Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑,
100 44 106 44
m n 31.2g-m 13.2g-n

=

,

=
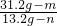
,
m=10g,n=4.4g,
碳酸钠的质量为:31.2g-10g=21.2g,
碳酸钠、碳酸钙、锌的质量分别为21.2g、10g、6.5g.
分析:(1)碳酸钙、锌不溶于水,碳酸钠易溶于水;
(2)根据反应物、生成物及其质量守恒定律可以书写化学方程式;
(3)用天平称量时,要注意的是应该左物右砝;
(4)碳酸钠、碳酸钙和稀盐酸反应都能够生成二氧化碳气体;
(5)通过计算可以确定物质的组成情况.
点评:差量法在计算中经常遇到,要掌握差量法计算的技巧,并且能够熟练运用,对解答计算方面的题目帮助很大.

 Cu+H2O.
Cu+H2O. Cu+H2O.
Cu+H2O.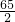 =
=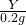 ,
, =
= ,
, =
=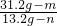 ,
,