
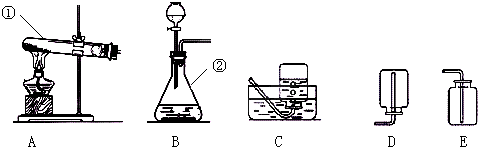
| ||
| ||
| ||
| ||
| 实验操作步骤 | 实验现象 | 实验结论 |
| ①取样品于试管中,加入适量水,充分振荡后静置并滴加几滴无色酚酞 ②或取样品于试管中,加入适量的稀盐酸 |
①试管中的液体呈红色 ② 没有气泡冒出 没有气泡冒出 |
①样品中含有: 氢氧化钙 氢氧化钙 ②样品中不含有碳酸钙. |
| ||
| ||
| ||
| ||
| 实验操作步骤 | 实验现象 | 实验结论 |
| ①取样品于试管中,加入适量水,充分振荡后静置并滴加几滴无色酚酞 ②或取样品于试管中,加入适量的稀盐酸 |
①试管中的液体呈红色 ②没有气泡冒出 |
①样品中含有:氢氧化钙; ②样品中不含有碳酸钙. |


科目:初中化学 来源: 题型:阅读理解
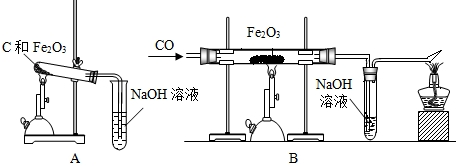
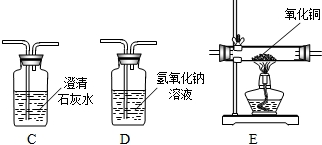
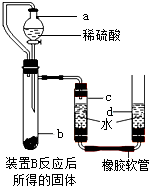
查看答案和解析>>
科目:初中化学 来源: 题型:
 .
.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.图1是稀释浓硫酸实验的示意图.
铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.图1是稀释浓硫酸实验的示意图.| 实验步骤 | 实验现象 | 结 论 |
取少量该溶液, 取少量该溶液, 向其中滴加 向其中滴加 石蕊 石蕊 溶液 溶液 |
溶液变红 溶液变红 |
为c处溶液,并推知溶液中的离子有 Na+、H+、SO42- Na+、H+、SO42- (填离子符号) |
查看答案和解析>>
科目:初中化学 来源: 题型:
 已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.
已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.| 实验步骤 | 实验现象 | 结论 |
| 取少量该溶液,加入适量的 石蕊试液 石蕊试液 |
试液变红 试液变红 |
为c处溶液,并推知原溶液中的离子有 Na+、H+、SO42- Na+、H+、SO42- (填写离子符号) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com