
【题目】某化学兴趣小组同学为回收一块质量为80g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸200g烧杯内剩余固体54g。请完成下列计算:
(1)80g铜锌合金中锌的质量是_______________________g。
(2)计算所用稀硫酸中溶质的质量分数__________________(写出计算过程)。
 小学能力测试卷系列答案
小学能力测试卷系列答案科目:初中化学 来源: 题型:
【题目】合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于任何一种组成金属的熔点。下表是一些金属的熔点数据:
金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
熔点/°C | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
(1)铅锡合金中某种金属的质量分数与合金的熔点有如图所示的关系,其中横坐标表示的是____________(填物质名称)的质量分数;当合金熔点最低时,合金中铅与锡的质量比为_______________。

(2)保险丝由铋、铅、锡、镉组成,其熔点约为_____________。
A 15~30 °C
B 60~80 °C
C 235~250° C
D 300~320°C
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,将一个新鲜的鸡蛋放入水中,鸡蛋沉入水中,加入适量稀盐酸后,鸡蛋会出现上浮、下沉再上浮、再下沉的现象,反复多次,且观察到鸡蛋上有气泡产生,某实验小组对该实验产生了兴趣,于是进行了如下探究。
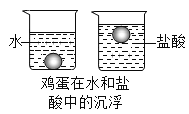
(一)定性分析
[查阅资料]鸡蛋壳含有钙元素。
[实验步骤及现象]取一些鸡蛋壳于一支洁净的试管中,加入过量稀盐酸,产生无色无味的气体,将该气体通入澄清石灰水中,石灰水变浑浊。
[实验结论及分析](1)鸡蛋壳的主要成分是:_________。
(2)写出澄清石灰水变浑浊的化学反应方程式:_________。
(二)定量分析
取2.00g鸡蛋壳样品,把20.00g稀盐酸分四次加入样品中,充分反应后过滤,取滤渣,洗涤、干燥、称量,得到的实验数据如表所示:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入5g | 1.5g |
第二次加入5g | 1.0g |
第三次加入5g | 0.5g |
第四次加入5g | 0.3g |
(1)根据表中数据画出所用稀盐酸的质量与剩余固体质量的关系图。_______
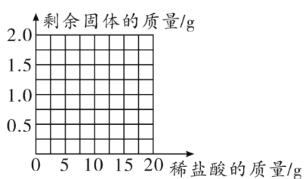
(2)从以上数据可知,这四次实验中,第_______次鸡蛋壳样品中主要成分完全反应。
(3)根据所绘曲线,计算鸡蛋壳中主要成分的质量分数为_____,所用稀盐酸的溶质质量分数为_____(结果精确到0.1% )。
(三)废液处理与反思
(1)由上述实验数据可知,实验结束后得到的滤液呈酸性,直接排放会造成管道腐蚀或污染环境,可向滤液中加入_______(填物质名称)调至滤液呈中性后再排放。
(2)食品中添加碳酸钙有助于防止人体缺钙引起的________(填“骨质疏松症”或“贫血”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】三种物质在密闭容器中发生反应,反应前后质量比例的变化关系如图所示,下列说法错误的是( )
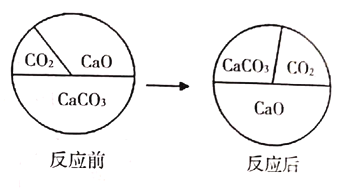
A.CaO为生成物
B.该反应是分解反应
C.反应后容器中固体质量减少
D.反应后容器中氧元素质量分数增大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】能源是人类生存和发展的基础,能源及其应用成为人们日益关注的问题。
(1)化石燃料是重要的能源,常温下呈液态的化石燃料为_______________________。
(2)人类大量使用化石燃料,使大气中的二氧化碳含量急剧增加。大量的二氧化碳进入海洋,使海洋中水的酸性增强,导致海洋“ 变酸”,用化学方程式解释海洋“变酸”的原因_______________________。
(3)若燃气灶的火焰成黄色,需要将节灶具的进风口的阀门调_______________________(填“大”或“小”);
(4)合理利用燃烧和灭火的原理很重要,乘坐公共汽车时,禁止携带酒精,原因是_______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A﹣H是初中化学常见的物质,其相互转化关系如图所示,其中A是人体胃液中帮助消化的物质,B 用于改良酸性土壤。
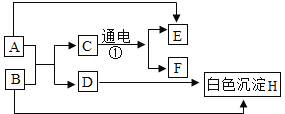
(1)D的化学式为_______。
(2)A转化为E 的化学方程式___________________。
(3)指出A转化为E反应的基本反应类型_______。
(4)指出物质 H 的一种用途_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】初中阶段学习了两大气体的制取方法和思路,根据下列实验装置图填空:
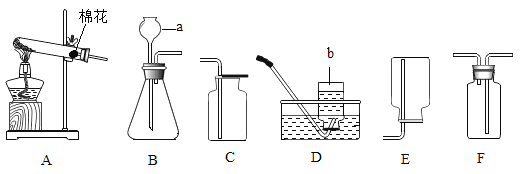
(1)写出所标仪器的名称:a是_____________,b是____________。
(2)写出用A装置制取氧气的化学方程式___________________________,若用F装置收集氧气,则气体应该从_______ 进入(选填“长管”或“短管”)。
(3)如果用装置B制取O2时,用注射器替换长颈漏斗,优点是__________________。
(4)实验室制取二氧化碳,选用的发生装置是___,化学反应方程式是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组对氯酸钾制取氧气的催化剂展开探究。请回答下列问题:
探究一:二氧化锰粒径大小对催化效果的影响

取两份等质量氯酸钾,分别加入等质量、粒径大小不同的二氧化锰进行加热,用传感器测得固体残留率(反应后剩余固体质量与反应前固体质量之比)如右图:
(1)二氧化锰作催化剂,加热氯酸钾制取氧气的化学方程式为_____________。
(2)查阅资料得知,发生反应的温度越低,催化效果越好。分析上图,对氯酸钾分解催化效果更好的是_____________。催化效果更好的原因可能是_____________。
探究二:催化剂用量及催化剂种类对催化效果的影响
同学们设计如下实验方案:
编号 | 氯酸钾质量/g | 催化剂 | 催化剂质量/g | 收集VmL氧气 所需时间/s |
实验1 | 5 | 171 | ||
实验2 | 5 | 二氧化锰 | 0.25 | 79 |
实验3 | 5 | 二氧化锰 | 0.5 | 49 |
实验4 | 5 | 二氧化锰 | 2.5 | 93 |
实验5 | 5 | 氧化铁 | 0.5 | 58 |
实验6 | 5 | 氯化钾 | 0.5 | 154 |
(3)表中所列三种催化剂中,催化效果最好的是_____________。
(4)二氧化锰与氯酸钾的质量比为_____________时,催化效果最好。
(5)氯化钾_____________(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集VmL氧气,所需时间明显少于171s,原因是_____________。
探究三:二氧化锰质量在反应前后的变化
同学们发现每次用氯酸钾和二氧化锰制取氧气结束后,在拆卸装置时总能闻到刺激性气味。他们将加热后剩余固体中的二氧化锰分离并测量其质量,发现总小于加热前二氧化锰的质量。查阅资料后发现,一般认为加热氯酸钾和二氧化锰混合物的反应过程如下:
第1步: ![]() (其中Cl2有刺激性气味)
(其中Cl2有刺激性气味)
第2步: ![]()
第3步: ![]()
(6)第3步反应中锰元素化合价变化为_____→________。
(7)反应后剩余固体中二氧化锰质量小于反应前的质量,原因可能是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图,下列说法中正确的是( )
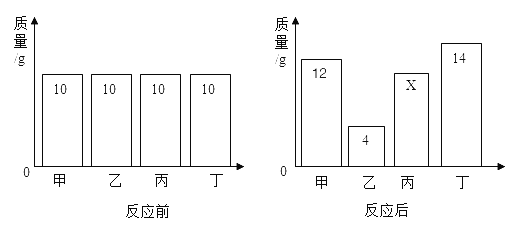
A. 该反应为化合反应
B. 丙一定为该反应的催化剂
C. 此反应中乙物质和丁物质的质量比为3:2
D. 丁的相对分子质量是甲的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com