
| A. | 稀有气体可做保护气,因为原子最外层电子层达到稳定结构 | |
| B. | 水和过氧化氢的化学性质不同,因为组成元素和分子构成不同 | |
| C. | NaOH溶于水温度升高,因为Na+、OH-扩散吸收的热量大于水合放出的热量 | |
| D. | 水通电生成氢气和氧气,因为水分子中含有氢分子和氧分子 |
分析 根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种物质的分子性质相同,不同物质的分子性质不同,结合事实进行分析判断即可.
解答 解:A、稀有气体可做保护气,是因为稀有气体化学性质很不活泼,它们原子的最外层电子层达到稳定结构,故选项解释正确.
B、水和过氧化氢均是由氢元素和氧元素组成的,水和过氧化氢的化学性质不同,是因为它们分子的构成不同,故选项解释错误.
C、NaOH溶于水温度升高,因为Na+、OH-扩散吸收的热量小于水合放出的热量,故选项说法错误.
D、水通电生成氢气和氧气,是因为水分子分裂成了氢原子和氧原子,然后氢原子、氧原子分别重新组合形成氢分子和氧分子,大量的氢分子、氧分子分别聚集成氢气、氧气,该事实说明分子是可以再分的;且分子是由原子构成的,故选项解释错误.
故选A.
点评 本题难度不大,掌握分子的基本性质及利用分子的基本性质分析和解决问题的方法是解答此类题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 有蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 | 沉淀不溶解,液体仍为无色 | 猜想一错误 |
| ④ | 将少许Cu(OH)2粉末加入到足量氢氧化钠浓溶液中,充分振荡 | 固体溶解,溶液呈亮蓝色 | 猜想二正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 ”代表氢原子,“
”代表氢原子,“ ”代表氮原子,“
”代表氮原子,“ ”代表氧原子),下列叙述中,正确的是( )
”代表氧原子),下列叙述中,正确的是( )
| A. | 该反应类型为置换反应 | |
| B. | 该反应中氧元素的化合价发生了变化 | |
| C. | 所得生成物Z和W的质量比为9:15 | |
| D. | 该反应中原子、分子种类都未发生变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
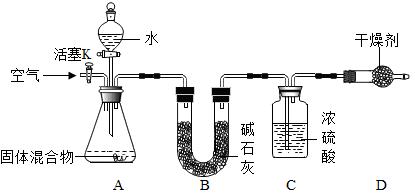
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 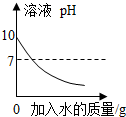 常温下向pH=10的NaOH溶液中不断加入水稀释 | |
| B. | 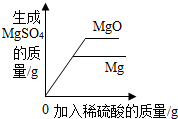 向等质量的Mg与MgO中分别加入足量等浓度的稀硫酸 | |
| C. | 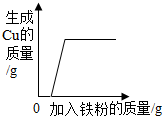 向一定量的AgNO3和Cu(NO3)2的混合溶液中不断放入铁粉 | |
| D. |  向一定量的部分变质的氢氧化钠溶液中滴加足量的稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 检验NaOH溶液是否变质:取样,滴入石蕊溶液 | |
| B. | 鉴别NaCl溶液和Na2CO3溶液:取样,测酸碱度 | |
| C. | 分离木炭粉和氧化铜的混合物:向固体中加入足量的稀硫酸后过滤 | |
| D. | 除去CO中的CO2气体和水蒸气:将混合气体依次通过浓硫酸和NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com